
科目: 来源: 题型:
X、Y、Z、W、R五种短周期非金属主族元素在元素周期表中的位置如图所示,下列有关说法正确的是( )
| X | Y | ||
| Z | W | R |
A.Z位于第三周期ⅤA族
B.X、Y的气态氢化物的稳定性:X>Y
C.原子半径大小顺序:Z>W>Y
D.W、R的最高价氧化物对应水化物的酸性:W>R
查看答案和解析>>
科目: 来源: 题型:
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
| X | Y |
| Z | W |
A.若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B.若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D.若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目: 来源: 题型:
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是( )
| X | Y | |
| Z | W |
A.元素X和元素W最高正价代数和一定为8
B.若元素X的原子序数为a,则Z的原子序数一定为a+9
C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物
D.原子半径的大小顺序为rW>rZ>rX>rY
查看答案和解析>>
科目: 来源: 题型:
下列有关元素周期表和元素性质的说法中正确的是( )
A.除短周期外,其他周期均有32种元素
B.同一主族元素的原子,最外层电子数相同,化学性质完全相同
C.副族元素中没有非金属元素
D.非金属元素只能形成共价化合物
查看答案和解析>>
科目: 来源: 题型:
如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
A.A、B简单离子半径大小关系为B3+>A2+
B.D、E形成的简单离子的还原性:E->D-
C.气态氢化物的稳定性:HD<H2C
D.最高价氧化物对应的水化物的酸性:H2CO4>HEO4
查看答案和解析>>
科目: 来源: 题型:
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以作半导体材料
D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2
查看答案和解析>>
科目: 来源: 题型:
下列排序正确的是( )
A.酸性:H2CO3<C6H5OH<CH3COOH
B.碱性:Ba(OH)2<Ca(OH)2<KOH
C.熔点:MgBr2<SiCl4<BN D.沸点:PH3<NH3<H2O
查看答案和解析>>
科目: 来源: 题型:
已知R元素的某种同位素能形成化合物AmRn,其中A的化合价为+n。该化合物中一个R微粒的核外电子数为a,核内中子数为b,则该同位素的原子符号是( )
A.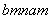 R B.
R B.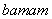 R
R
C.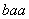 R D.
R D.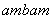 R
R
查看答案和解析>>
科目: 来源: 题型:
为了合理 利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量 。试写出甲醇燃烧的热化学方程式:_______________________________________________________。
。试写出甲醇燃烧的热化学方程式:_______________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形 成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2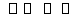 2NH3 ΔH=a kJ·mol-1。
2NH3 ΔH=a kJ·mol-1。
试根据表中所列键能数据计算a的数值(列出简单的计算式):________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g)
ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):
__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com