
科目: 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)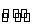 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
| 容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中 的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量akJ |
| ② | 2 | 3 | 0 | 放出热量bkJ |
| ③ | 2 | 6 | 0 | 放出热量ckJ |
下列叙述正确的是( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
查看答案和解析>>
科目: 来源: 题型:
下列叙述与图像对应符合的是( )
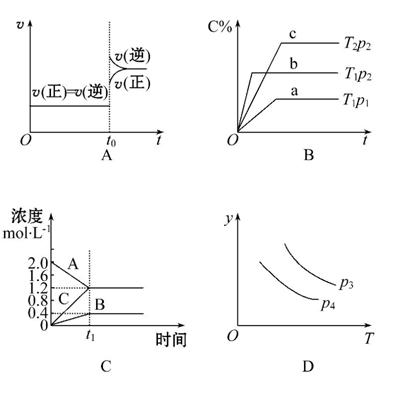
A.对于达到平衡状态的N2(g)+3H2(g) 2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
B.p2>p1,T1>T2
C.该图像表示的方程式为:2A====B+3C
D.对于反应2X(g)+3Y(g) 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
查看答案和解析>>
科目: 来源: 题型:
某可逆反应平衡常数表达式为K= 。达到平衡状态时,如果升高温度(其他条件不变),则c(NO)减小。下列说法正确的是
。达到平衡状态时,如果升高温度(其他条件不变),则c(NO)减小。下列说法正确的是
( )
A.反应的热化学方程式为NO2(g)+SO2(g) NO(g)+SO3(g) ΔH>0
NO(g)+SO3(g) ΔH>0
B.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深
C.混合气体的平均摩尔质量保持不变,说明反应已达平衡
D.使用合适的催化剂可使该反应的反应速率和平衡常数增大
查看答案和解析>>
科目: 来源: 题型:
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g)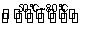 Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
反应二:Ni(CO)4(g)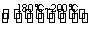 Ni(纯,s)+4CO(g) ΔH>0
Ni(纯,s)+4CO(g) ΔH>0
下列说法错误的是( )
A.对于反应一,适当增大压强,有利于Ni(CO)4的生成
B.提纯过程中,CO气体可循环使用
C.升高温度,反应一的反应速率减小,反应二的速率增大
D.对反应二,在180℃~200℃,温度越高,Ni(CO)4(g)的转化率越高
查看答案和解析>>
科目: 来源: 题型:
一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应A(s)+2B(g) C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如下图所示。下列说法正确的是( )
C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如下图所示。下列说法正确的是( )
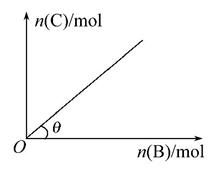
A.增加A的物质的量,正反应速率加快
B.平衡时,其他条件不变,当温度升高时,θ变大
C.图中曲线的斜率表示反应的化学平衡常数
D.平衡时,其他条件不变,再通入B,则反应混合物的温度升高
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中,有下列反应:
N2(g)+3H2(g) 2NH3(g) ΔH=-93.4 kJ·mol-1
2NH3(g) ΔH=-93.4 kJ·mol-1
有关该反应的叙述正确的是( )
A.若混合气体中各成分的浓度不再变化,则该反应已达平衡状态
B.将1 mol N2和3 mol H2充分反应达到平衡时,放出的热量等于93.4 kJ
C.催化剂能缩短该反应达到平衡所需的时间,从而提高N2的转化率
D.缩小容器的体积,v(正)增大、v(逆)减小,平衡向右移动
查看答案和解析>>
科目: 来源: 题型:
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生氢气的体积(大于25 mL),并检验氯气的氧化性。
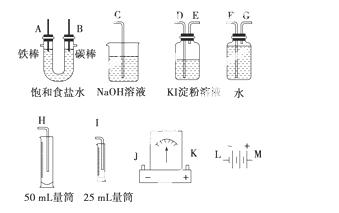
(1)A极发生的电极反应式是________________________________________________,
B极发生的电极反应式是__________________________________________________。
电解饱和食盐水的化学方程式______________________________________________。
(2)电源、电流表与A、B两极的正确连接顺序为:L→( )→( )→( )→( )→M。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:________接________、________接A、B接________、________接________。
(4)在实验中,盛 有KI淀粉溶液的容器中发生反应的离子方程式为__________________________________________________。
有KI淀粉溶液的容器中发生反应的离子方程式为__________________________________________________。
(5)已知饱和食盐水50 mL,某时刻测得H2体积为5.6 m L(标准状况)。此时溶液pH约为__________________________________________________。
L(标准状况)。此时溶液pH约为__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
如图为相互串联的甲、乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发现石墨电极附近先变红。请回答:
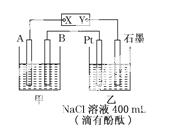
(1)电源X极为______极(填“正”或“负”),乙池中Pt电极上的电极反应式为______。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为______,电路中通过的电子为______mol。
(3)若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)=____________。
查看答案和解析>>
科目: 来源: 题型:
工业上由黄铜矿(主要成分CuFe S2)冶炼铜的主要流程如下:
S2)冶炼铜的主要流程如下:
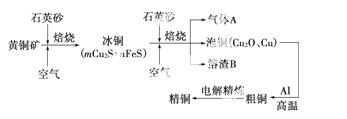
(1)气体A中的大气污染物可选用下列试剂中的________吸收。
A.浓H2SO4 B.稀HNO3
C.NaOH溶液 D.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是__________________________________________________
__________________________________________________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为__________________________________________________。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4== =2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________________________________________。
=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
用惰性电极进行下列电解,有关说法正确的是( )
①电解稀硫酸 ②电解CuSO4溶液 ③电解KOH溶液 ④电解NaCl溶液
A.电解进行一段时间后四份溶液的pH均增大
B.②中电解一段时间后,向溶液中加入适量的CuO固体可使溶液恢复电解前的情况
C.③中阳极消耗OH-,故溶液浓度变小
D.④中阴、阳两极上产物的物质的量之比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com