
科目: 来源: 题型:
根据酸碱的质子理论,“凡是能给出质子的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。”按这个理论,下列微粒:
①HS-,②CO32-,③HPO42-,④NH3,⑤OH-,⑥H2O,⑦HCO3-,⑧HAc,⑨KHSO4
(1)只属于碱的微粒是: ;
(2)只属于酸的微粒是: ;
(3)属于两性的微粒是: 。(填编号)。
查看答案和解析>>
科目: 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O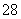 +2I-===2SO
+2I-===2SO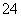 +I2 (慢)
+I2 (慢)
I2+2S2O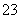 ===2I-+S4O
===2I-+S4O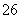 (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O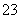 与S2O
与S2O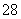 初始的物质的量需满足的关系为n(S2O
初始的物质的量需满足的关系为n(S2O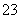 )∶n(S2O
)∶n(S2O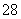 )__________。
)__________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=______________, 理由是___________________________________。
理由是___________________________________。
(3)已知某条件下,浓度c(S2O )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。

(4)碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________;碘电极作为该电池的________极。
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中发生反应N2+3H2 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
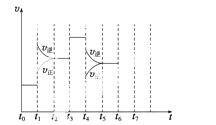
回答下列问题:
(1)处于平衡状态的时间段是________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项)。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻__ ______;t3时刻________;t4时刻________。
______;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平 衡状态,请在图中画出反应速率的变化曲线。
衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。
查看答案和解析>>
科目: 来源: 题型:
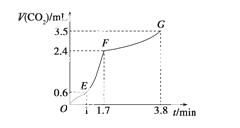
现欲用碳酸钙固体和稀盐酸反应制取CO2气体。请回答下列问题。
(1)写出发生反应的离子方程式:_________________________________________。
(2)实验过程中绘制出生成CO2的体积V(CO2)与时间t的关系如下图所示。试分析判断OE段、EF段、FG段反应速率[分别用v(OE)、v(EF)、v(FG)表示]的大小关系为____________;比较OE段和EF段,说明EF段速率变化的主要原因:
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如下图所示,回答下列问题:
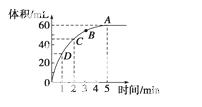
(1)A、B、C、D四点化学反应速率快慢的顺序为
________________________________________________________________________。
(2)解释反应速率变化的原因
________________________________________________________________________。
(3)计算过氧化氢的初始 物质的量浓度
物质的量浓度
________________________________________________________________________。
(4)求反应进行到2分钟时过氧化氢的质量分数。
查看答案和解析>>
科目: 来源: 题型:
可逆反应mA(g)+nB(g)  pC(g)+gD(g)的v-t图像如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图Ⅱ所示。
pC(g)+gD(g)的v-t图像如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图Ⅱ所示。
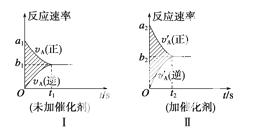
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2
⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图Ⅱ中阴影部分面积更大
以上所列正确的为 ( )
A.②④⑤⑦ B.②④⑥⑧
C.②③⑤⑦ D.②③⑥⑧
查看答案和解析>>
科目: 来源: 题型:
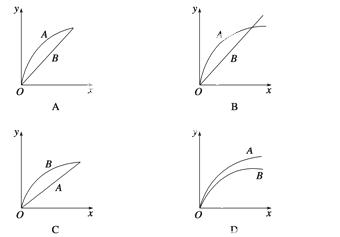
进行如下实验,在A锥形瓶中放入10 g绿豆大小的碳酸钙,在B锥形瓶中放入5 g粉末状的碳酸钙,分别加入50 mL 1 mol·L-1盐酸,下图中能正确表示实验结果的是(注:x-时间,y-锥形瓶中碳酸钙减少的质量) ( )
查看答案和解析>>
科目: 来源: 题型:
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C
2C (g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
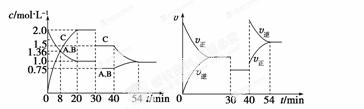
下列说法中正确的是  ( )
( )
A.30~40 min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
在容积不变的密闭容器中存在如下反应:
2SO2(g)+O2(g) 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
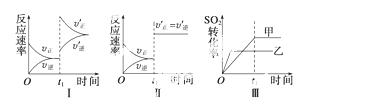
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目: 来源: 题型:
下列关于催化剂的说法不正确的是 ( )
A.温度越 高,催化剂的催化效果越好
高,催化剂的催化效果越好
B.汽车排气管上的“催化转化器”能减少有害气体排放
C.催化剂可以改变化学反应速率,但反应前后质量和化学性质不变
D.锌与盐酸反应时,加入几滴硫酸铜溶液可加快化学反应速率,但硫酸铜不作催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com