
科目: 来源: 题型:
二元酸H2A的电离反应如下:
H2A  HA- + H+ K1 = 4.50×10-7 HA-
HA- + H+ K1 = 4.50×10-7 HA- A2- + H+ K2 = 4.70×10-11
A2- + H+ K2 = 4.70×10-11
用0.300 mol·L-1 HCl滴定含有Na2A和NaHA的一份20.00 mL的溶液,滴定进程用玻璃电极pH计跟踪,滴定曲线上的两个点对应的数据如下:
| 加入的HCl/mL | 1.00 | 10.00 |
| pH | 10.33 | 8.34 |
(1)加入1.00 mL HCl时首先与HCl反应的物种是什么?产物是什么?
(2)(1)中生成的产物有多少mmol?
(3)写出(1)中生成的产物与溶剂反应的主要平衡式
(4)起始溶液中存在的Na2A和NaHA的量各有多少mmol?
(5)计算为达到第二个等当点所需要HCl的总体积。
查看答案和解析>>
科目: 来源: 题型:
丙二酸(H2A)的pKa1 = 2.86,pKa2 = 5.70,向20.00 mL Na2A、NaHA混合溶液中加入1.00 mL 0.0100 mol·L-1 HCl,pH为5.70;滴入同样浓度10.00 mL HCI,pH为4.28,求初始混合液中Na2A、NaHA浓度和pH。
查看答案和解析>>
科目: 来源: 题型:
 在一定温度下,难溶化合物饱和溶液的离子浓度的乘积为一常数,这个常数用
在一定温度下,难溶化合物饱和溶液的离子浓度的乘积为一常数,这个常数用 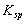 表示。已知:
表示。已知: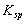 (AgCl) = = 1.8×10-10;
(AgCl) = = 1.8×10-10;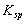 (Ag2CrO4) = 2 = 1.9×10-12
(Ag2CrO4) = 2 = 1.9×10-12
现有0.001 mol·L-1 AgNO3溶液滴定0.001 mol·L-1 KCl和0.001 mol·L-1 的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42- 哪种先沉淀?
(2)当CrO42- 以 Ag2CrO4 形式沉淀时,溶液中的Cl- 离子浓度是多少? CrO42- 与Cl- 能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5 mol·L-1 时,则认为可以达到有效分离)
查看答案和解析>>
科目: 来源: 题型:
用有关理论解释下列事实:甲学生在制得Mg(OH)2沉淀中加入浓氯化铵溶液,结果沉淀完全溶解,乙学生在制得的Mg(OH)2沉淀中加入浓醋酸铵溶液,结果沉淀也完全溶解。
查看答案和解析>>
科目: 来源: 题型:
已知硫酸的第一步电离(H2SO4 = H++HSO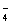 )是完全的,但第二步电离(HSO
)是完全的,但第二步电离(HSO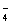
 H+ + SO
H+ + SO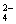 )并不完全。如果25℃时,01 mol·L-1 H2SO4溶液中c(SO
)并不完全。如果25℃时,01 mol·L-1 H2SO4溶液中c(SO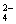 ) = 0.010 mol·L-1,01 mol·L-1 NaHSO4溶液中c(SO
) = 0.010 mol·L-1,01 mol·L-1 NaHSO4溶液中c(SO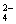 ) = 0.029 mol·L-1,试回答:
) = 0.029 mol·L-1,试回答:
(1)25℃时,01 mol·L-1 H2SO4溶液中pH = ;(可用对数表示)
(2)为何01 mol·L-1 的H2SO4 溶液中的c(SO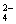 )比01 mol·L-1 的NaHSO4 溶液中c(SO
)比01 mol·L-1 的NaHSO4 溶液中c(SO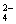 ) 小?
) 小?
(3)0.1 mol·L-1 Na2SO4溶液的pH值 7(填大于、小于或等于)
(4)固体NaHSO4与固体食盐混和共热至600℃,能否得到HCl气体?为什么?
(5)常温下测得0.25 mol·L-1的CuSO4溶液的pH值为5,025 mol·L-1 Cu(ClO4)2溶液的pH值为45,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
已知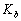 = 1.8 ×10-5,计算 0.10 mol·L-1 的 NH3·H2O 的 ;若向其中加入固体NH4Cl ,使 的浓度达到 0.20 mol·L-1 ,求 。
= 1.8 ×10-5,计算 0.10 mol·L-1 的 NH3·H2O 的 ;若向其中加入固体NH4Cl ,使 的浓度达到 0.20 mol·L-1 ,求 。
查看答案和解析>>
科目: 来源: 题型:
把0.10 mol CH3COONa加到1.0 L 0.10 mol·L-1 CH3COOH溶液中(设加CH3COONa溶液体积不变),求溶液的pH(已知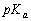 = 4.74)。
= 4.74)。
查看答案和解析>>
科目: 来源: 题型:
经测定,H2O2为二元弱酸,其酸性比碳酸弱,它在碱性溶液中极不稳定,易分解生成H2O和O2。若向Na2O2中通入干燥的CO2气体,Na2O2与CO2并不起反应。
(1)写出H2O2在水溶液中的电离方程式
(2)用化学方程式表示Na2O2和潮湿的CO2气体反应的过程。
查看答案和解析>>
科目: 来源: 题型:
人体血液的pH值变化范围较小,pH值只能在7.0~7.8的范围内变化,否则将会有生命危险。实验证明,在50 mL的血液中加入1滴(0.05 mL)10 mol·L-1 的盐酸时,pH值由7.4降至7.2,如果向50 mL、pH值为7.4的NaOH溶液中加入1滴(0.05mL)10 mol·L-1盐酸时,pH值大约将变为 。显然,人体血液具有 的作用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com