
科目: 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 1L 1mol•L﹣1的NaClO 溶液中含有ClO﹣的数目为NA |
|
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA |
|
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下) |
|
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:
下列各组离子在指定溶液中关于离子共存的说法正确的是( )
|
| A. | 25℃时溶液中一定大量共存:Na+、Ca2+、Cl﹣、SO42﹣ |
|
| B. | 能与铝反应放出氢气的溶液中一定共存:Mg2+、Cu2+、SO42﹣、NO3﹣ |
|
| C. | 弱碱性溶液中可能大量共存:Na+、K+、Cl‾、HCO3‾ |
|
| D. | 0.1mol/LFeCl3溶液中可能大量共存:Fe2+、NH4+、SCN﹣、SO42﹣ |
查看答案和解析>>
科目: 来源: 题型:
下列指定反应的离子方程式正确的是( )
|
| A. | Cu溶于稀硝酸:Cu+2H++NO3﹣=Cu2++NO2↑+H2O |
|
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2﹣+2H2O=Al(OH)3↓+HCO3﹣ |
|
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH﹣=Fe(OH)2↓ |
|
| D. | 用CuCl2溶液做导电性实验,灯泡发光:CuCl2 |
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 标准状况下,40g SO3的体积为11.2L |
|
| B. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
|
| C. | 5NH4NO3 |
|
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目: 来源: 题型:
性质决定用途,化学知识运用得当可以使人类的生活更美好.下列物质性质与应用的对应关系正确的是( )
|
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 |
|
| B. | 浓硫酸具有酸性,可用于刻蚀玻璃制品 |
|
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 |
|
| D. | 氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
查看答案和解析>>
科目: 来源: 题型:
2013年12月15日,嫦娥三号着陆器与巡视器分离,“玉兔号”巡视器顺利驶抵月球表面.“玉兔”号是中国首辆月球车,成功实现对月面的科学探测.“玉兔”号用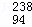 Pu作为热源材料.下列关于
Pu作为热源材料.下列关于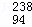 Pu的说法正确的是( )
Pu的说法正确的是( )
|
| A. |
|
|
| B. |
|
|
| C. |
|
|
| D. |
|
查看答案和解析>>
科目: 来源: 题型:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L—1 H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。已知:金属离子氢氧化物沉淀所需pH是
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3. 3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A.MgO B.Na2CO3 C.蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如图所示。
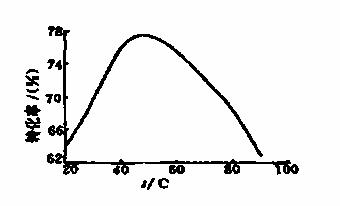
①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是 。
查看答案和解析>>
科目: 来源: 题型:
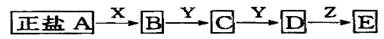 |
当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素
回答下列问题(用化学式填写):
(1)A是________________,Y是_______________,Z是________________.
(2)当X是强碱时,E是________________.
(3)当X是强酸时,E是________________.
(4)写出A与X(是强酸时)反应的离子方程式__________________________.
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL 2 mol・L―1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件回答:
(1)元素C位于第__________周期第__________族,它的最高价氧化物的化学式为____________。
(2)A元素是_________,B元素是________,D元素是_______。(填名称)
(3)A与D形成稳定化合物的电子式是_____________,判断该化合物在空气中是否变质的简单方法是_______________________________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
“温室效应”是哥奉哈根世界气候变化大会研究的环境问题之一。CO2气体在大气层中具有吸热和隔热的功能,是主要的温室气体。
(1)下列措施中,有利于降低大气中CO2浓度的是 (填字母编号)。
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导“低碳”生活
c.利崩太阳能、风能等新型能源替代化石燃料 ·
(2)CH4是另一种主要的温室气体,l克甲烷完全燃烧生成液态水和二氧化碳,放出55.64 kJ的热量,写出甲烷的燃烧热的热化学方程式 。
(3)酸阿的形成主要是由废气中的SOx和NOx造成的。通过SO2和Br2、H2O的定量反应在电解池中产生的电流变化,可以准确测定空气中SO2的含量。该反应的化学方程式为 。
(4)某硫酸工厂以黄铁矿为原料生产硫酸。 第一阶段燃烧黄铁矿的化学方程式为4FeS2+11O2 2Fe2O3+8SO2;第二阶段的反应原理是2SO2(g)+O2(g)
2Fe2O3+8SO2;第二阶段的反应原理是2SO2(g)+O2(g) 2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样分析:SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是 (填字母编号)
2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样分析:SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是 (填字母编号)
a. SO2为5mol·L-1,O2为3.5mol·L-1 b. SO2为3mol·L-1
c. SO2、SO3均为2.5mol·L-1 d. SO3为5mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com