
科目: 来源: 题型:
下列实验“操作和现象”与“结论”都正确的是
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铝箔插入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 溶液中有Fe3+生成 |
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物
B.Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同
C.乙醇分子中含羟基,可与金属钠反应生成氢气
D.MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.SO2和NO2都是酸性氧化物,都能与水反应生成酸
B.Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同
C.Al2O3和Na2O按物质的量比1:1投人水中可得到澄清溶液
D.金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气
查看答案和解析>>
科目: 来源: 题型:
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是
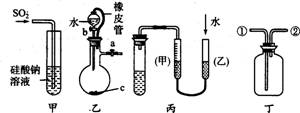
A.甲装置:可用来证明硫的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法能检查此装置的气密性
D.丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
科目: 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是
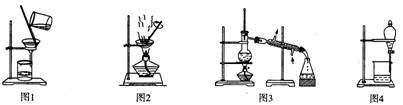
A.用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B.用图2所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H20晶体
C.用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇
D.用图4所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含 (填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含 所致.
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的.
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 |
|
|
| 方案2 |
|
|
(4)结论:氧化性:Br2>Fe3+.故在足量的氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为: .
(5)实验后的思考:
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先氧化的离子是 (填离子符号).
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有的Br﹣被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为 .
查看答案和解析>>
科目: 来源: 题型:
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等.水垢会形成安全隐患,需及时清洗除去.清洗流程如下:
Ⅰ.加入NaOH 和 Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(资料在线:K3[Fe(CN)6]溶液遇亚铁盐会生成蓝色沉淀.)
(1)用NaOH溶解二氧化硅的化学方程式是 .
(2)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有 .
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 .
(3)步骤Ⅲ中,加入Na2SO3的目的是 .
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
Fe+ NO2+ H2O═ N2↑+ +
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面.下面检测钝化效果的方法合理的是 .
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间.
查看答案和解析>>
科目: 来源: 题型:
中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4.请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有 .
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为 .
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.写出A与X的溶液反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
取xg铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g.则x等于( )
|
| A. | 8.64g | B. | 9.20g | C. | 9.00g | D. | 9.44g |
查看答案和解析>>
科目: 来源: 题型:
下列有关说法正确的是( )
|
| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后PH>7,则c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+) |
|
| B. | 已知MgCO3的Ksp=6.82×10﹣6,则所有含有固体MgCO3的溶液中,都有C(Mg2+)=C(CO32﹣),且C(Mg2+)•C(CO32﹣)═6.82×10﹣6 mol•L﹣1 |
|
| C. | 0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合: c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) |
|
| D. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com