
科目: 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 铁制品上电镀锌时,理论上电镀液ZnCl2需要不断更换 |
|
| B. | 钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
|
| C. | 甲烷燃料(KOH)电池的正极反应为:O2+2H2O+4e﹣=4OH﹣ |
|
| D. | 粗铜精炼过程中,电路中每通过2mol电子,阳极就会溶解64g铜 |
查看答案和解析>>
科目: 来源: 题型:
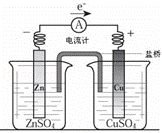
关于如图所示装置的下列叙述,正确的是( )
|
| A. | 电流方向是从锌片经导线流向铜片 |
|
| B. | 锌是阳极,锌片上有大量气泡产生 |
|
| C. | 铜离子在铜片表面被氧化,质量逐渐增大 |
|
| D. | 盐桥作用主要是离子通道和保持溶液电中性 |
查看答案和解析>>
科目: 来源: 题型:
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);△H<0(kJ•mol﹣1)的化学反应,下列叙述一定正确的是( )
|
| A. |
反应过程中能量关系可用右图表示 |
|
| B. | 1mol锌的能量高于1molH2所含的能量 |
|
| C. | 若将该反应设计成原电池,则锌为正极 |
|
| D. | 若将其设计为原电池,则当有32.5g锌溶解时,正极放出的气体体积一定为22.4L(标况) |
查看答案和解析>>
科目: 来源: 题型:
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
Ⅰ、热化学方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B | C |
| 反应物投入量 | 1molCO2(g)和 3molH2(g) | 1molCH3OH(g)和 1molH2O(g) | 2molCO2(g)和6mol H2(g) |
| CH3OH(g)浓度(mol/L) | c1 | c2 | c3 |
| 反应能量变化 | 放出29.4kJ | 吸收a kJ | 放出b kJ |
①从反应开始到达平衡时,A中用CO2来表示的平均反应速率为 0.03 mol/(L•s)(用具体数值表示)
②a= 19.6 .c1 = c2 < 1/2c3(填“>”“<”或“=”).
Ⅱ、CO可用于合成甲醇.在压强0.1MPa条件下,向体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图1所示

(1)该反应属于反应 放热 (填“吸热”或“放热”);P2 > 0.1MPa(填“>”“<”或“=”)
(2)100℃时,该反应的平衡常数K= 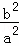 (用含a、b的代数式表示)
(用含a、b的代数式表示)
Ⅲ、碳一化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.CO与NO在催化剂的条件下反应如下:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0,在绝热、恒容的密闭容器中加入一定量的NO和CO发生上述反应,图2的示意图不能说明反应在进行到t1时刻达到平衡状态的是 c (填字母序号)
查看答案和解析>>
科目: 来源: 题型:
草酸(H2C2O4)是二元中强酸,酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.
Ⅰ、某探究小组利用该反应,用浓度为0.1000mol•L﹣1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式为 2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O .
(2)滴定过程中操作滴定管的图示正确的是 A .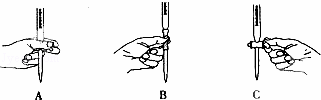
(3)本滴定达到终点的标志是: 当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
(4)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 偏高 ,
(填“偏高”、“偏低”、或“不变”).
Ⅱ、草酸氢钠溶液显酸性,常温下,向10mL 0.01mol/LNaHC2O4溶液中滴加0.01mol/LNaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是: BD
A、V(NaOH)=0时,c(H+)=1×10﹣2 mol/L
B、V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)
C、V(NaOH)=10mL时,c(H+)=1×10﹣7 mol/L
D、V(NaOH)>10mL时,c(Na+)>c(C2O42﹣)>c(HC2O4﹣)
查看答案和解析>>
科目: 来源: 题型:
在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,已知a+b=12,向该溶液中逐滴加入NaHSO4溶液,测得混合溶液的部分PH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的PH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | X | 7 |
| ③ | 33.00 | 33.00 | 6 |
(1)依据题意判断,T℃ 大于 25℃(填“大于”、“小于”或“等于”)
(2)b= 4 ,X= 27
(3)反应③的离子方程式为: Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中c(Ba2+):c(OH﹣) 1:20 .
查看答案和解析>>
科目: 来源: 题型:
已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如下(图中部分反应物或产物已省略):
请填空
(1)B的电子式 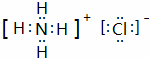 ,B物质的水溶液呈 酸性 ,原因是 NH4++H20⇌NH3.H2O+H+ (用离子方程式表示)
,B物质的水溶液呈 酸性 ,原因是 NH4++H20⇌NH3.H2O+H+ (用离子方程式表示)
(2)反应①的离子反应方程式为 Mg+2NH4+=Mg2++2NH3↑+H2↑
(3)操作a必须在HCl气流中加热得无水物,其原因是 抑制Mg2+的水解 ;操作b为 熔融状态下电解
(4)K+G+F→L写出该反应的化学方程式 4NO2+O2+2H2O=4HNO3 ,
(5)已知C的燃烧热为286KJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式 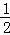 H2(g)+
H2(g)+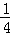 O2(g)=
O2(g)=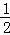 H2O(l)△H=﹣143kJ/mol .
H2O(l)△H=﹣143kJ/mol .
查看答案和解析>>
科目: 来源: 题型:
NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容.
(1)请写出实验室制取NH3的化学方程式 Ca(OH)2+2NH4Cl  CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因 氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出.同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出.
多余 (用离子方程式和简要的文字说明)
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的  ,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理.设计成NH3﹣O2燃料电池,碱性条件下该电池负极电极反应为: 2NH3+6OH﹣﹣6e﹣=N2+6H2O .
查看答案和解析>>
科目: 来源: 题型:
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)⇌xC(g)+D(s),向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C和2mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是( )
|
| A. | 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4 |
|
| B. | 平衡时,甲、乙两容器中A、B的物质的量之比不相等 |
|
| C. | 平衡时甲中A的体积分数为40% |
|
| D. | 若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com