
科目: 来源: 题型:
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )

|
| A. | 升高温度,平衡常数减小 |
|
| B. | Z在a、c两点的反应速率相等 |
|
| C. | b点时,Z的转化率最小 |
|
| D. | 平衡时充入惰性气体时,平衡向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:
下列图示与对应叙述相符合的是( )
|
| A. | 图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
|
| B. | 图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
|
| C. | 图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
|
| D. | 图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目: 来源: 题型:
对下列实验的描述正确的是( )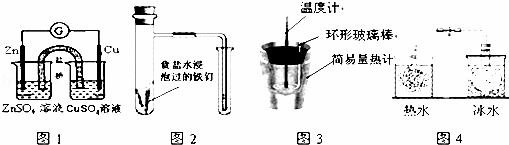
|
| A. | 图1所示的实验:根据电流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性 |
|
| B. | 图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
|
| C. | 图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热 |
|
| D. | 图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)⇌N2O4(g)是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
|
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 |
|
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
|
| C. | 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L•min) |
|
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
查看答案和解析>>
科目: 来源: 题型:
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点.其中一种镁电池的反应原理为:xMg+Mo3S4 Mg2Mo3S4,下列说法不正确的是( )
Mg2Mo3S4,下列说法不正确的是( )
|
| A. | 放电时,Mo3S4发生氧化反应 |
|
| B. | 放电时,正极反应式:Mo3S4+2xe﹣→Mo3S42x﹣ |
|
| C. | 充电时,Mg2+向阴极迁移 |
|
| D. | 充电时,阴极反应式:xMg2++2xe﹣→xMg |
查看答案和解析>>
科目: 来源: 题型:
将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:(g)+2Y(g)⇌2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是( )
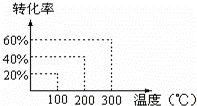
|
| A. | 100℃ | B. | 200℃ | C. | 300℃ | D. | 不能确定 |
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,不正确的是( )
|
| A. | 某特定反应的平衡常数仅是温度的函数 |
|
| B. | 催化剂不能改变平衡常数的大小 |
|
| C. | 平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
|
| D. | 化学平衡发生移动,平衡常数必发生变化 |
查看答案和解析>>
科目: 来源: 题型:
下列化学反应的速率,一定是前者大于后者的( )
|
| A. | 反应A+B |
|
| B. | 相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 |
|
| C. | 相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 |
|
| D. | 一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
|
| A. | 化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
|
| B. | 凡是放热反应都是自发的,吸热反应都是非自发的 |
|
| C. | 若一个反应的平衡常数越大,则表示该反应速率也越大 |
|
| D. | 升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
查看答案和解析>>
科目: 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2 |
|
| B. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol |
|
| C. | 500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) |
|
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2589.6kJ/moL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com