
科目: 来源: 题型:
下列说法正确的是( )
A.苯和溴水振荡后,由于发生化学反应而使溴水的水层颜色变浅
B.酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷
C.煤中含有苯和甲苯,可以用先干馏,后蒸馏的方法把它们分离出来
D.石油中含有C5~C11的烷烃,可以通过分馏得到汽油
查看答案和解析>>
科目: 来源: 题型:
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A.植物油不能使溴水褪色 B.淀粉水解的最终产物是葡萄糖
C.葡萄糖、蔗糖都能水解 D.蛋白质溶液中滴加硝酸汞溶液后可发生盐析
查看答案和解析>>
科目: 来源: 题型:
已知:4NH3+5O2 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(1)a mol NO完全转化为HNO3理论上需要氧气 mol.
(2)为使NH3恰好完全氧化为NO,氨﹣空气混合气体中氨的体积分数(用小数表示)为 (保留2位小数).
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为NO和HNO3的总转化率.
(4)20.0mol NH3和一定量空气充分反应后,再转化为硝酸.通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.
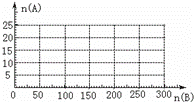
查看答案和解析>>
科目: 来源: 题型:
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
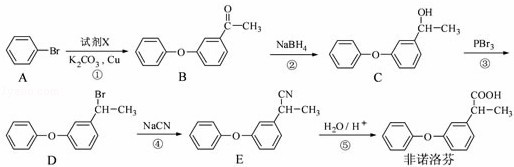
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称).
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 .
(3)在上述五步反应中,属于取代反应的是 (填序号).
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应.
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环.
写出该同分异构体的结构简式: .
(5)根据已有知识并结合相关信息,写出以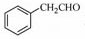 为原料制备
为原料制备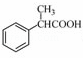 的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
CH3CH2Br CH3CH2OH
CH3CH2OH CH3COOCH2CH3.
CH3COOCH2CH3.
查看答案和解析>>
科目: 来源: 题型:
不饱和酯类化合物在药物、涂料等领域应用广泛.下列反应是一种由烯烃制备不饱和酯的新方法:

(1)化合物I的分子式为 ,1mol化合物I能与 mol H2恰好完全反应生成饱和烃类化合物.
(2)化合物Ⅰ可由芳香族化合物Ⅱ或Ⅲ分别通过消去反应获得,但只有Ⅱ能与Na反应产生H2,Ⅱ的结构简式为 、 ;由Ⅲ生成Ⅰ的反应条件为 .
(3)聚合物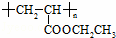 可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
.
查看答案和解析>>
科目: 来源: 题型:
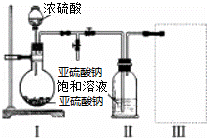
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为 .
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为 (填序号)

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是 .
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 .
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g•L﹣1.
②在上述实验过程中,若有部分HI被空气氧化,则测定结果 (填“偏高”“偏低”或“不变”).
查看答案和解析>>
科目: 来源: 题型:
实验室从含碘废液(除H2O外,还含有CCl4、I2、I﹣)中回收碘,其实验过程如图1:
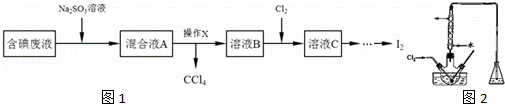
(1)向含碘废液中加入稍过量的Na2SO3溶液时发生的离子方程式为 ;该操作的目的是 .
(2)操作X应在 (填写仪器名称图2)中进行,简述得到溶液B的过程:将混合溶液静置后,
(3)在三颈瓶中将溶液B用盐酸调至pH约为2,缓慢通入Cl2,在40˚C左右反应(实验装置如右图所示).实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 (填溶质的化学式).
(4)某含碘废水(pH约为4)中一定存在I2,可能存在I﹣或IO3﹣.可以使用 (填溶质的化学式,下同)溶液检验可能存在的I﹣或 溶液检验可能存在的IO3﹣.在检验该含碘废水中是否含有I﹣或IO3﹣前必需要进行的操作是 (填序号).
a.取适量含碘废水用CCl4多次萃取、分液
b.用NaOH溶液将溶液调节到中性
c.向溶液中滴入少量淀粉溶液.
查看答案和解析>>
科目: 来源: 题型:
铁及其化合物与生产、生活关系密切.
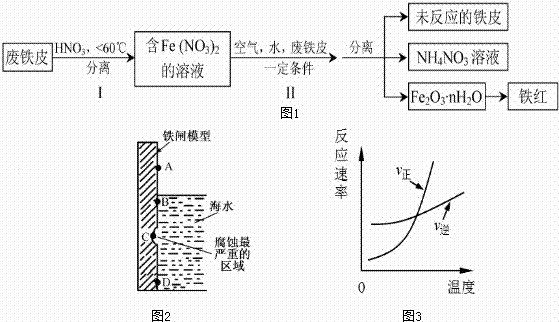
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3•nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
查看答案和解析>>
科目: 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
(1)与氯元素同族的短周期元素的原子结构示意图为 .
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+ 3 H2O═ NaClO3+ .
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其他晶体析出的原因是 .
(4)一定条件下,在水溶液中1mol Cl﹣、ClOx﹣(x=1,2,3,4)的能量(kJ)相对大小如图所示.
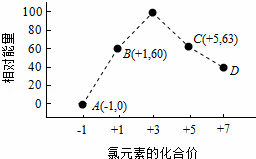
①D是 (填离子符号).
②B→A+C反应的热化学方程式为 (用离子符号表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com