
科目: 来源: 题型:
(1)恒温,容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
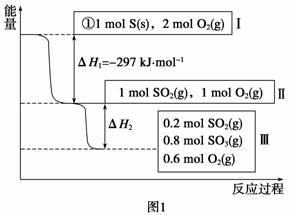
①写出能表示硫的燃烧热的热化学方程式: ________________________________。
②ΔH2=__________kJ·mol-1。

 ③在相同条件下,充入2mol SO2和2mol的O2,则达到平衡时SO3的转化率比原平衡______________(“大”、“小”或“相等”);此时该反应放出的热量________(“大于”、“小于”或“等于”)2ΔH2 。
③在相同条件下,充入2mol SO2和2mol的O2,则达到平衡时SO3的转化率比原平衡______________(“大”、“小”或“相等”);此时该反应放出的热量________(“大于”、“小于”或“等于”)2ΔH2 。
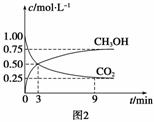 (2)①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)
(2)①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。
从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D. 工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目: 来源: 题型:
I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是_________________。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c 0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度
c(A-)_____c(Na+)(选填“>”、“<”或“=”)从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”)。
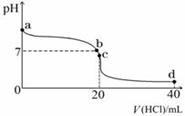 Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。 (1)NH3·H2O的电离方程式是 。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。 (1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
科目: 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
查看答案和解析>>
科目: 来源: 题型:
下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是( )
①pH=0的盐酸 ②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液 ④pH=11的NaOH溶液
A.1∶10∶100∶1 000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
查看答案和解析>>
科目: 来源: 题型:
下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰或铵态氮肥不能混合施用 ④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.浓度均为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,
则:c(CH3COO-)<c(CH3COOH)
B.浓度均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-) + c(NH3·H2O)
C.浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合:
c(Na+)+ c(H+)= c(CO32-)+ c(OH-) + c(HCO3-)
D.用pH=3的HCl溶液滴定10 mL pH=11的氨水,达到滴定终点用去盐酸的体积小于10 mL
查看答案和解析>>
科目: 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,Na2CO3溶液中存在CO +H2O
+H2O HCO
HCO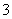 +OH-平衡。下列说法不正确的是 ( )
+OH-平衡。下列说法不正确的是 ( )
A.稀释溶液,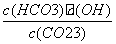 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,平衡常数增大
D.加入NaOH固体,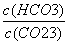 减小
减小
查看答案和解析>>
科目: 来源: 题型:
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl+S+SO2。请问下列说法错误的是( )
A、电池的负极材料为Li B、负极发生的电极反应为Li – e- = Li+;
C、电池正极发生的电极反应为2SOCl2+4e- = 4Cl-+S+SO2;
D、组装该电池可在水溶液的条件下进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com