
科目: 来源: 题型:
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA
B. 常温常压下,28 g C2H4、C O的混合气体中含有碳原子的数目为1.5NA
O的混合气体中含有碳原子的数目为1.5NA
C.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
D. 标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
查看答案和解析>>
科目: 来源: 题型:
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用。下列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.推广碳捕集和储存技术,逐步实现二氧化碳零排放
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
科目: 来源: 题型:
五种短周期元素的某些性质如表所示(其中Z、M、W为同周期元素)。
| 元素代号 | Y | X | W | M | Z |
| 原子半径(×10-12 m) | 64 | 73 | 78 | 96 | 113 |
| 主要化合价 | -1 | +5、-3 | +7、-1 | +4、-4 | +3 |
下列说法不正确的是( )
A.由M与W形成的化合物是含有极性键的极性分子
B. X与M之间形成的化合物,其晶体是原子晶体
C.由M元素形成的晶体,是太阳能光伏发电的主要材料,工业上制取M单质,可通过置换反应原理来生产
D.Y与Z元素形成的[ZY6]3-,离子中存在配位键,该离子构型呈正八面体
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
⑶若XM3最初水解产物是XH3和HMO,则X、M元素的电负性大小顺序是:X_____M((填>、<、或=);若已知磷与M元素电负性关系是:P<M,则PM3水解的化学反应方程式是 。
(4)已知QM3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,则QM3是_________(填“离子化合物”或“共价化合物”),如何通过实验判别__________________。在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g/L,则QM3的结构式为_________。
(5)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Z与X形成只含一个中心原子的共价化合物,则它的分子式是 ,其分子的立体结构是 。
(2)Y的最高价氧化物晶体类型是 晶体。X的氧化物与Y的最高氧化物中,分子极性较小的是(填分子式) 。
(3)右图是W的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。(图中实心球表示W元素)
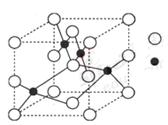
(4)铜元素和W元素都位于周期表的ds区,胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如右,有关它的说法正确的是 ________(填字母)。
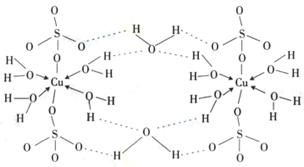
A.该胆矾晶体中存在配位键、共价键和离子键
B.该结构中还存在金属键,极性共价键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、
另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6
pm,则此晶胞的密度为  (保留两位有效数字)。(
(保留两位有效数字)。( )
)

(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构
如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出
上述过程的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
铬及其化合物应用广泛。例如用经硫酸酸化处理的三氧化铬(CrO3)硅胶测试司机呼出的气体,根据硅胶颜色的变化可以判断司机是否酒驾
(1)基态铬原子的电子排布式为 。
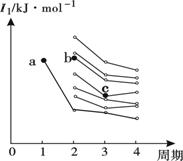
(2)右图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(3)测试过程中,乙醇被氧化为乙醛(CH3CHO)。乙醇与乙醛
的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
(4)氯化铬酰(CrO2Cl2)可用作染料溶剂,熔点为-96.5℃,沸点为117℃,能与四氯化碳等有机溶剂互溶。氯化铬酰晶体属于 (填晶体类型)。
(5)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+ 形式存在。
①上述溶液中,不存在的微粒间作用力是 (填标号)。
A.离子键 B.共价键 C.金属键D.配位键 E.范德华力
②[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
(6)在酸性溶液中,H2O2能与重铬酸盐作用生成蓝色的CrO5,离子方程式为:
4H2O2 + 2H+ + Cr2O72- =2CrO5 + 5H2O根据下图所示Cr2O72-和CrO5的结构判断,上述反应 (填“是”或“不是”)氧化还原反应。
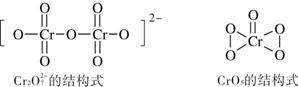
查看答案和解析>>
科目: 来源: 题型:
在5-氨基四唑(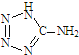 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
(1)基态Ga原子的电子排布式可表示为 ;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为 ;在1mol 5-氨基四唑中含有的σ键的数目为 .
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的 空间构型为 .
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如上图示)顶点的氮原子,这种碳氮化钛化合物的化学式为 .
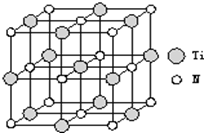
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 。(填写元素符号)
④ [Ti(OH)2(H2O)4]2+中的化学键有 。
a.σ键 b.π键 c.离子键 d.配位键
查看答案和解析>>
科目: 来源: 题型:
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)Cu2+的外围电子排布图可表示为_______________________________________;
(2)Mn基态原子核外处在能量最高的能级上的电子共有________种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成CO2,HCHO被氧化成CO2和H2O
① N3-和CO2是等电子体,则N3-的结构式为_________________________________;
② HCHO分子中C原子轨道的杂化类型为___________________________________;
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH) 4]2-的结构可用示意图表示为______________________________;
(5) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示:3.613=47.05),又知铜的密度为9.00g·cm-3,则铜晶胞的质量是________________________g(保留两位小数);阿伏加德罗常数为_____________________________________(列式计算,保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com