
科目: 来源: 题型:
已知还原性 I— > Fe2+ > Br—,在只含有I—、Fe2+、Br—溶液中通入一定量的氯气,关于所得溶液离子成分分析正确的是(不考虑Br2 、I2和水的反应)( )
A.I—、Fe3+ 、Cl— B.Fe2+、Cl—、Br‑ C.Fe2+、Fe3+ 、Cl— D.Fe2+、I— 、Cl—
查看答案和解析>>
科目: 来源: 题型:
化学与生活密切相关,下列说法正确的是( )
A.福尔马林可用于保存海鲜产品[ B.鸡蛋清中加入CuSO4溶液会发生变性
C.合成橡胶与光导纤维都属于有机高分子材料
D.丝绸和棉花的组成元素相同,分子结构不同,因而性质不同
查看答案和解析>>
科目: 来源: 题型:
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1) Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为________。
 ②BH
②BH 的空间构型是________(用文字描述)。
的空间构型是________(用文字描述)。
(2) 液氨是富氢物质,是氢能的理想载 体,利用N2+3H2
体,利用N2+3H2
 2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
A. NH3分子中N原子采用sp3杂化
B. 相同压强时,NH3沸点比PH3高
C.[Cu (NH3)4]2+离子中,N原子是配位原子
D.CN-的电子式为[:C┇┇N:]-
 (3) 2008年,Yoon等人发现Ca与C60(分子结构如下图左)生成的Ca32C60能
(3) 2008年,Yoon等人发现Ca与C60(分子结构如下图左)生成的Ca32C60能 大量吸附H2分子。
大量吸附H2分子。

①C60晶体 易溶于苯、CS2,C60是________分子(填“极性”或“非极性”)。
易溶于苯、CS2,C60是________分子(填“极性”或“非极性”)。
②1 mol C60分子中,含有σ键数目为________。
(4) MgH2是金属氢化物储氢材料,其晶胞结构如上图右所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为________cm3[a、NA表示(NA表示阿伏加德罗常数的值)]。
查看答案和解析>>
科目: 来源: 题型:
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·
O2(g)===CO2(g) ΔH=-283.0 kJ· mol-1
mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲 醇反应的反应速率的是________(填写序号).
醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
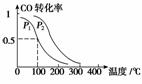
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大” 、“
、“ 减小”或“不变”)。
减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。

查看答案和解析>>
科目: 来源: 题型:
含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知:
(1) 在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
① 写出Cr2O 与FeSO4溶液在酸性条件下反应的离子方程式:________________。
与FeSO4溶液在酸性条件下反应的离子方程式:________________。
② 用离子方程式表示溶液pH不能超过10的原因:____。
(2) 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
① 写出阴极的电极反应式:________________。
② 电解法中加入氯化钠的作用是________________。
(3) 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。

① CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为____。
② CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如右图所示,则B点时剩余固体的成分是________________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率 ,具体情况如图所示。
,具体情况如图所示。
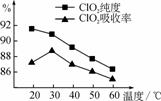
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO 氧化成SO
氧化成SO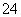 ,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+===Cl-+5Fe3++2H2O
14H++Cr2O +6Fe2+===2Cr3++6Fe3++7H2O
+6Fe2+===2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
普罗帕酮为广谱高效膜抑制性抗心律失常药。其合成路线如下:
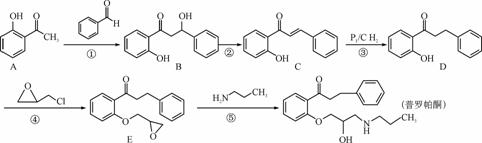
(1) 化合物C的含氧官能团为________和________(填官能团的名称)。
(2) 反应①→④中属于加成反应的是________(填序号)。
(3) 写出同时满足下列条件的A的同分异构体结构简式:________。
Ⅰ. 分子中含有苯环,且苯环上的一氯代物有两种;
Ⅱ. 与FeCl3溶液发生显色反应;
Ⅲ. 能发生银镜反应。
(4) 产物普罗帕酮中会混有少量副产物F(分子式为C21H27O3N)。F的结构简式为________。
(5) 化合物3羟基戊二酸二乙酯( )是一种医药中间体,请结合流程信息,写出以丙酮、乙醇和甲醛为原料,制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)是一种医药中间体,请结合流程信息,写出以丙酮、乙醇和甲醛为原料,制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
H2C==CH2 CH3CH2Br
CH3CH2Br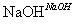 CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目: 来源: 题型:
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
 |
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时 发生反应的化学方程式: 。
发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目: 来源: 题型:
.T1℃时,向容积为2 L的密闭容器中 充入一定量的A气体和B气体,发生如下反应:
充入一定量的A气体和B气体,发生如下反应:
A(g)+2B(g) C(g)
C(g)
反应过程中测定的部分数据见下表:
| 反应时间/min | n(A)/mol | n(B)/ mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目: 来源: 题型:
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体的成分中含有NH 、Fe2+、SO
、Fe2+、SO
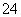 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成 ,则可证明晶体的成分中含有结晶水
,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液 ,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH
,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO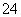

D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com