
科目: 来源: 题型:
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II. 将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV. TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。
|


②如实验IV中,应将TiO2.xH2O放在_______ (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电
子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的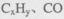 等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。
某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为P g/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
| |
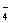 + H2O2+ H+= Mn2++ H2O+
+ H2O2+ H+= Mn2++ H2O+ ②滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________。
③重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________ (填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如下图所示:
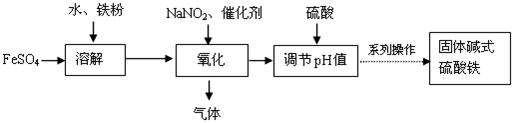
已知: Fe3+沉淀完全时的pH=3.1, Fe2+沉淀完全时的pH=9.7。
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施:
_______________________________,______________________________。
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成 沉淀;若硫酸加入量过大,不利于产品形成,试从平衡移动的角度分析原因是 。
(3)氧化过程中生成的气体遇空气变红棕色。写出氧化过程发生的离子方程式:
________________________________________________________________。
(4)流程图中的“系列操作”包括 , ,过滤,洗涤,烘干。
查看答案和解析>>
科目: 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
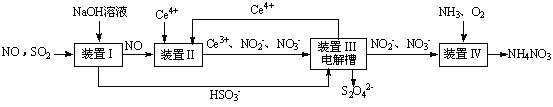
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
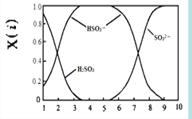
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
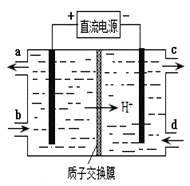
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目: 来源: 题型:
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示 H,则
H,则 H=____________________;
H=____________________;
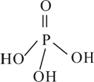
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为________________________________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)_____ Ni2+ + ____ H2PO2-+ _____ → ___Ni++______ H2PO3-+ ____
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:______________________________________________________;
原理上的不同点:______________________________________________________;
化学镀的优点:________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为 ;
②硫酸钠和焦炭、石灰石反应的化学方程式为_ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
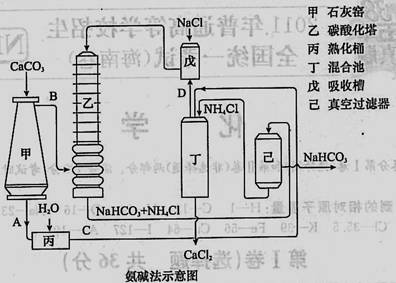
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法对氨碱法的改进,其优点是 ;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行? 。
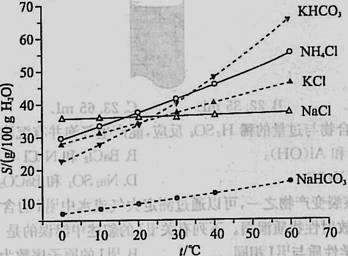
查看答案和解析>>
科目: 来源: 题型:
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)  CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=________,反应
CO2(g)+H2(g)的平衡常数K2=________,反应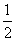 CO2(g)+
CO2(g)+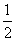 H2(g)
H2(g) 
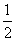 CO(g)+
CO(g)+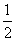 H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
一定条件下,在体积为3 L的密闭容器中反应CO(g)+2H2(g)  CH3OH(g) ΔH=a kJ·mol-1,ΔS=b J·mol-1·K-1(a、b均为正数),达到化学平衡状态。
CH3OH(g) ΔH=a kJ·mol-1,ΔS=b J·mol-1·K-1(a、b均为正数),达到化学平衡状态。
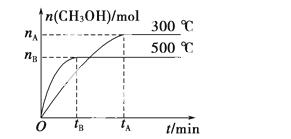
(1)500 ℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是________(填字母)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(3)300 ℃时,将容器的容积压缩到原来的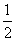 ,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时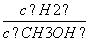 减小
减小
查看答案和解析>>
科目: 来源: 题型:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用引起了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),该反应的能量变化如图所示:
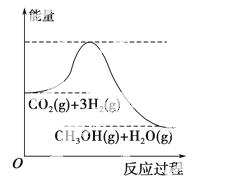
(1)上述反应平衡常数K的表达式为______________________________________________,
温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2 )=________。
)=________。
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是________(填写序号字母)。
a.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
b.容器内压强保持不变
c.H2的消耗速率与CH3OH的消耗速率之比为3∶1
d.容器内的密度保持不变
查看答案和解析>>
科目: 来源: 题型:
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g)2B(g) ΔH=a  kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
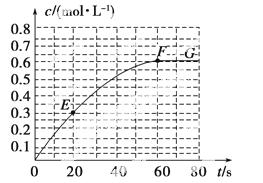
试回答下列问题:
(1)已知298 K时60 s达到平衡,则前60 s内A的平均反应速率为________mol·L-1·s-1。
(2)该反应的平衡常数表达式为________。
(3)若298 K时B的平衡浓度为A的3倍,323 K时( 其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的
其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的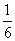 。该反应中ΔH________0(填“>”或“<”)。
。该反应中ΔH________0(填“>”或“<”)。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时B的转化率为________(填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是______________________________________________ __________________________。
查看答案和解析>>
科目: 来源: 题型:
向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
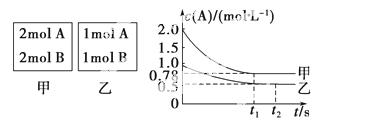
回答下列问题:
(1)乙容器中,平衡后物质B的转化率为________。
(2)x=________。
(3)T ℃时该反应的平衡常数为________。
(4)下列说法正确的是( )。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com