
科目: 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
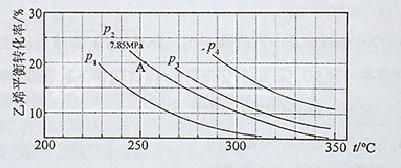
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
查看答案和解析>>
科目: 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)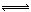 NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO( g)+Cl2(g)
g)+Cl2(g)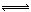 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s)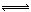 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=  (用K1、K2表示)。
(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min 内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶 液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
查看答案和解析>>
科目: 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g) CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g) 1/2C(s)+1/2CO2(g) △H3=-86
1/2C(s)+1/2CO2(g) △H3=-86 .2kJ/mol
.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g) CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图18.结合各反应的△H,归纳lgK~T曲线变化规律:
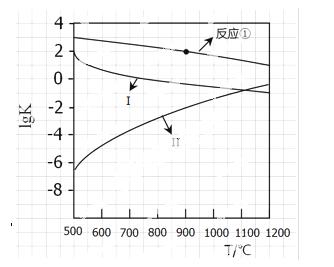
a)
b)
(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900 ºC达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入 。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为 ;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1) (1)已知AX3的熔点 和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX
AX 5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
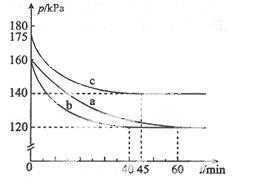
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
 ;实验a和c的平衡转化率:αa为 、αc为 。
;实验a和c的平衡转化率:αa为 、αc为 。
查看答案和解析>>
科目: 来源: 题型:
工业上可用CO2生产甲醇,反应为CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图7-2实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化。下列说法正确的是( )
CH3OH(g)+H2O(g)。将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图7-2实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化。下列说法正确的是( )
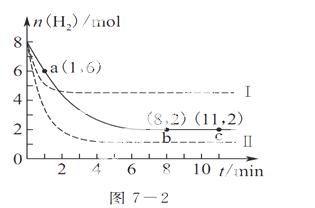
A.曲线Ⅱ对应的条件改变是降低压强
B.若曲线Ⅰ对应的条件改变是升高温度,则该反应ΔH>0
C.反应开始至a点时v(H2)=1 mol·L-1·min-1
D.其他条件不变,若降低该反应的温度,平衡常数值将减小
查看答案和解析>>
科目: 来源: 题型:
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)上述正向反应是________反应(填“放热”或“吸热”)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向________反应方向移动(填“正”或“逆”),正反应速率________(填“增大”“减小”或“不变”),容器内混合气体的压强________(填“增大”“减小”或“不变”)。
(4)在830 ℃发生上述反应,按下表中的物质的量投入恒容反应器,其中在向正反应方向移动的有________(选填A、B、C、D)。
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目: 来源: 题型:
一定温度下,向某恒容的密闭容器中加入0.2 mol CO和0.2 mol H2O,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2。下列说法正确的是( )
CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2。下列说法正确的是( )
A.缩小容器体积,混合气体密度不变
B.v逆(CO)=v逆(CO2)时,表明反应达到平衡状态
C.平衡时CO和H2O的转化率相等
D.无法计算该条件下反应的平衡常数
查看答案和解析>>
科目: 来源: 题型:
据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g)。某科研小组将2 mol CO2与4 mol H2通入一体积不变的密闭容器甲进行上述反应,下列叙述正确的是 ( )
CH3CH2OH(g)+3H2O(g)。某科研小组将2 mol CO2与4 mol H2通入一体积不变的密闭容器甲进行上述反应,下列叙述正确的是 ( )
A.当v(CO2)正=2v(CH3CH2OH)正时,反应一定达到平衡状态
B.当平衡向正反应方向移动时,平衡常数一定增大
C.当CO2和H2的物质的量比不变时,说明反应已达平衡状态
D.当容器中混合气体的密度不变时,反应已达平衡状态
查看答案和解析>>
科目: 来源: 题型:
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下(
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下(  )
)
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目: 来源: 题型:
一定温度下,在2 L恒容密闭容器中发生反应:2N2O5(g)  4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图73所示,下列说法正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图73所示,下列说法正确的是( )
A.10 min时,反应达到平衡
B.达到平衡时N2O5的转化率为60%
C.0~20 min内平均反应速率v(N2O5)=0.05 mol·L-1·min-1
D.曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com