
科目: 来源: 题型:
已知在25 ℃条件下向10.00 mL 0.1 mol·L-1 HCOOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。 下列说法中不正确的是( )
下列说法中不正确的是( )
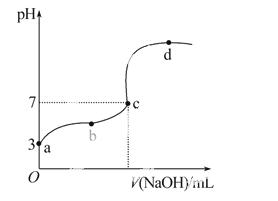
A.a点表示的溶液中c(HCOO-)约为10-3 mol·L-1
B.用25 mL的酸式滴定管量取HCOOH溶液
C.c点NaOH溶液的体积小于10 mL
D.在a、c间任一点,溶液中一定都有c(Na+)>c(HCOO-)> c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
化学 中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
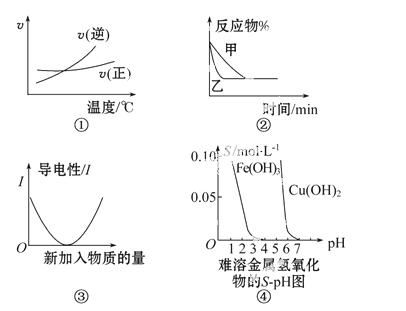
A.根据图①可判断可逆反应A2(g)+3B2(g)  2AB3(g),正反应是吸热反应
2AB3(g),正反应是吸热反应
B.图②表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④溶解度与溶液pH的关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目: 来源: 题型:
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
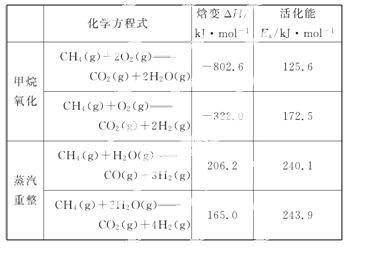
回答下列问题:
(1)反应CO(g)+H2O(g)====CO2(g)+H2(g)的ΔH=_____kJ·mol-1。
(2)在初始阶段,甲烷蒸汽重整的反应速率________甲烷氧化的反应速率(填“大于”“小于”或“等于”)。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)  CO(g)+3H2(g)的Kp=______;随着温度的升高,该平衡常数_________ (填“增大”“减小”或“不变”)。
CO(g)+3H2(g)的Kp=______;随着温度的升高,该平衡常数_________ (填“增大”“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于___________________________________。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图:
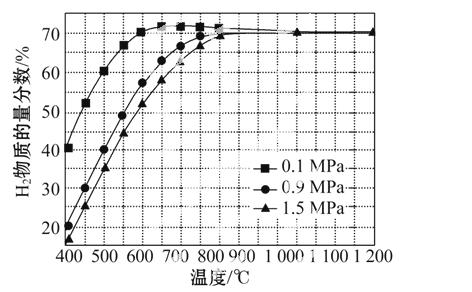
①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是______________。
A.600 ℃,0.9 MPa B.700 ℃,0.9 MPa
C.800 ℃,1.5 MPa D.1 000 ℃,1.5 MPa
②画出600 ℃,0.1 MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
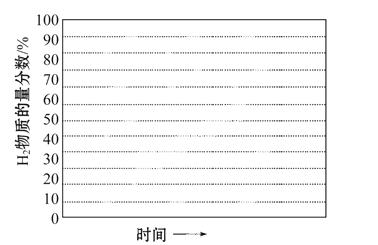
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
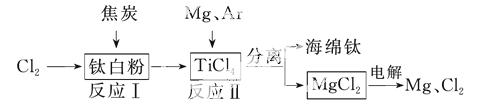
已知:
①Mg(s)+Cl2(g)===MgCl2(s) ΔH=-641 kJ·mol-1
②Cl2(g)+1/2Ti(s)===1/2TiCl4(l) ΔH=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解反应生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解反应的离子方程式为______________。
(2)反应Ⅰ在800~900 ℃的条件下进行, 还生成一种可燃性无色气体,该反应的化学方程式为_____;反应Ⅱ的热化学方程式为____。
(3)该工艺流程中,可以循环使用的物质有________。
(4)在800~1 000 ℃时电解TiO2也可制得海绵钛,装置如图所示。图 中b是电源的________极(填“正”或“负”),该电解池阴极的电极反应式为_____________。
中b是电源的________极(填“正”或“负”),该电解池阴极的电极反应式为_____________。
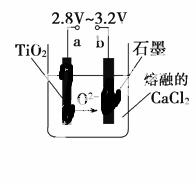
查看答案和解析>>
科目: 来源: 题型:
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
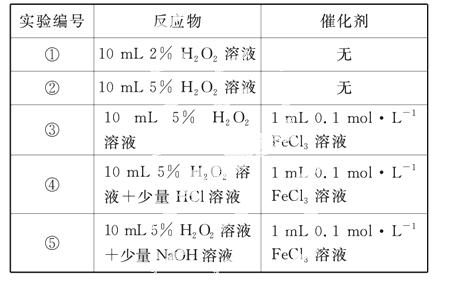
(1)催化剂能加快化学反应速率的原因是____________。
(2)实验①和②的目的是___________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是__________。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
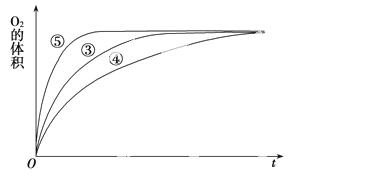
分析上图能够得出的实验结论是____________________。
查看答案和解析>>
科目: 来源: 题型:
减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧废渣产生的SO2制备硫酸锰的生产流程如下:
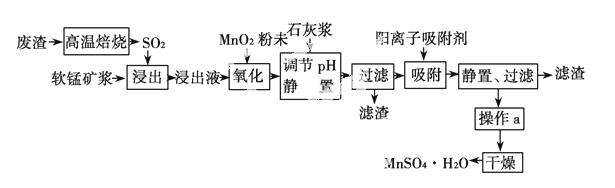
浸出液的pH<2,其中的金属离子主要是 Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。有关金属离子的半径以及形成氢氧化物沉淀时的pH如表所示,阳离子吸附剂吸附金属离子的效
Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。有关金属离子的半径以及形成氢氧化物沉淀时的pH如表所示,阳离子吸附剂吸附金属离子的效 果如图所示。
果如图所示。
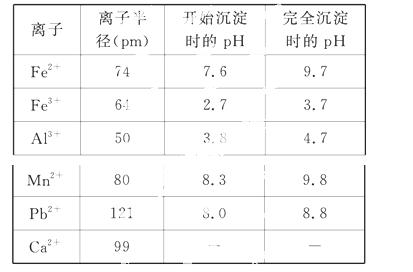
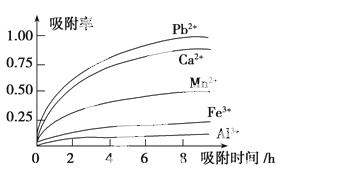
已知PbO2的氧化性大于MnO2的氧化性。请回答下列问题:
(1)废渣的主要成分是硫铁矿,1 mol F eS2高温焙烧转移________ mol电子。
eS2高温焙烧转移________ mol电子。
(2)在氧化后的浸出液中加入石灰浆,用于调节浸出液的pH,pH应调节至________。
(3)阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是________(填写序号)。
a.溶液的pH值 b.金属离子的电荷
c.金属离子的半径 d.吸附时间
(4)操作a包括________等过程。
查看答案和解析>>
科目: 来源: 题型:
常温下向20 mL 0.1 mol/L的Na2CO3溶液中逐滴加入0.1 mol/L的HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳组分的百分含量(纵坐标)也发生变化(CO2因逸出未画出),如图所示,下列说法正确的是( )
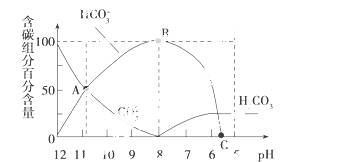
A.0.1 mol/L的Na2CO3溶液中c(Na+)+c(H+)=2c(CO )+c(HCO
)+c(HCO )+c(OH-)
)+c(OH-)
B.在A点c(Na+)>c(CO )>c(HCO
)>c(HCO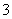 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.常温下CO2的饱和溶液的pH约为5.6
D.0.05 mol/L的NaHCO3溶液的pH=8
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2)及各种物质的相对浓度随时间的变化,记录于图中。根据图中数据,下列推论最不合理的是( )
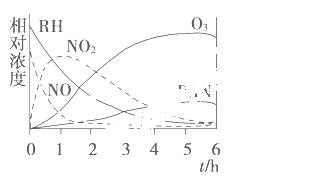
A.NO消失的速率比RH快
B.NO生成NO2
C.RH及NO2反应生成PAN及O3
D.O3生成PAN
查看答案和解析>>
科目: 来源: 题型:
草酸是二元中强酸,测得0.01 mol·L-1的草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1NaHC2O4溶液中滴加0.01 mol·L-1NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是 ( )
A.V(NaOH)=0 mL时,c(Na+)>c(H+)>c(HC2O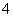 )>c(C2O
)>c(C2O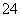 )>c(OH-)
)>c(OH-)
B.V(NaOH)=5 mL时,c(Na+)=c(C2O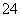 )+c(HC2O
)+c(HC2O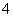 )+c(H2C2O4)
)+c(H2C2O4)
C.V(NaOH)=10 mL时,c(Na+)=c(HC2O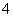 )+2c(C2O
)+2c(C2O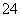 )
)
D.V(NaOH)>10 mL时,c(Na+)>c(C2O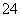 )>c(HC2O
)>c(HC2O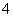 )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com