
科目: 来源: 题型:
如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视,所以“低碳经济”正成为科学家研究的主要课题.
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡梁/mol | 达到平衡所需时间/nin |
| |
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 .(精确到0.01,下同)
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= .
(2)以二甲醚(CH3OCH3)、空气、氢氧化钾为原料,铂为电极可构成燃料电池,其工作原理 与甲烷燃料电池的原理相似.请写出该电池负极上的电极反应式: .
(3)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为﹣285.8kJ•mol﹣1、﹣283.0kJ•mol ﹣1和﹣726.5kJ•mol﹣1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
某盐X由非金属元素组成,不稳定加热时分解,生成等物质的量的气态氢化物A和B.A、C、E、G、I含有同种元素,C为黄色固体单质.B、D、F、H、J含有同种元素,B可与J反应生成盐.W是具有红色金属光泽的金属.上述物质转化关系如图,部分产物和条件已略去.请回答下列问题:

(1)X的化学式
(2)写出由E生成G的化学反应方程式
(3)写出反应B+Y→D+Z的化学方程式
(4)由E直接转换成I可以加入 (填写两种属于不同类别的物质).
(5)标况下,4.48LA与J的浓溶液反应转移1.6mole﹣,写出此反应的离子方程式 .
(6)将0.1mol/L 100mL I和0.4mol/L 100mL J溶液混合,加入1.92g W,加热,待充分反应后,所得溶液中W金属离子的物质的量浓度为 .
查看答案和解析>>
科目: 来源: 题型:
已知可逆反应:M(g)+N(g)⇌P(g)+Q(g)△H>0,请回答下列问题.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol•L﹣1,c(N)=2.4mol•L﹣1,达到平衡后,M的转化率为60%,此时N的转化率为 .
(2)若反应温度升高,M的转化率 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L﹣1,a= .
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol•L﹣1,达到平衡后,M的转化率为 .
查看答案和解析>>
科目: 来源: 题型:
某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸,且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有 ,请写出该反应的离子方程式:
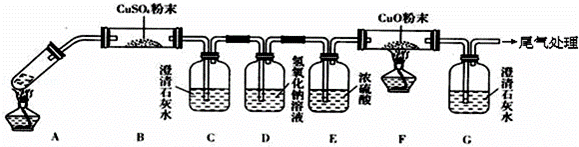
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红.据此回答:上述装置中,D的作用是 .乙二酸分解的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.
该燃料电池负极电极反应式为 ;
该燃料电池正极电极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
(1)电池正极发生的电极反应为 ;
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成. 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
Li﹣Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e﹣=Li2S+Fe.有关该电池的下列说法中,正确的是( )
|
| A. | Li﹣Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
|
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe |
|
| C. | 负极的电极反应式为Al﹣3e﹣=Al3+ |
|
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS |
查看答案和解析>>
科目: 来源: 题型:
有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图所示)在保持400℃的条件下使之发生如下反应:2SO2+O2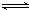 2SO3.则下列描述正确的是( )
2SO3.则下列描述正确的是( )

|
| A. | 达到平衡所需要的时间:A容器更短 |
|
| B. | 达到平衡时:B容器中SO3的转化率更大 |
|
| C. | 达到平衡时:A容器中SO2的物质的量更多 |
|
| D. | 达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大,B容器中SO3的体积分数不变 |
查看答案和解析>>
科目: 来源: 题型:
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O.当有1mol H2O参与反应时,转移电子的物质的量为( )
|
| A. | 0.5 mol | B. | 1 mol | C. | 2 mol | D. | 4 mol |
查看答案和解析>>
科目: 来源: 题型:
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2恰好恢复到电解前的浓度和pH.则电解过程中转移电子的总物质的量为( )
|
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com