
科目: 来源:专项题 题型:实验题
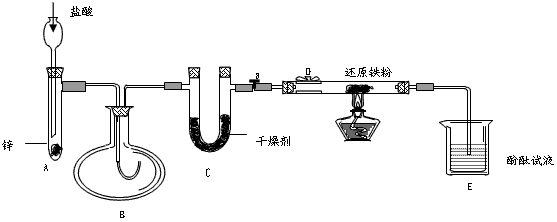
查看答案和解析>>
科目: 来源:专项题 题型:实验题
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
查看答案和解析>>
科目: 来源:同步题 题型:实验题
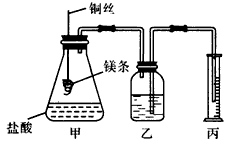
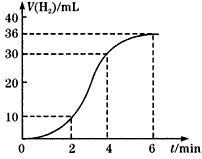
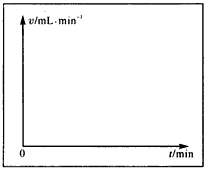
查看答案和解析>>
科目: 来源:同步题 题型:实验题
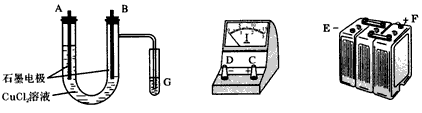
查看答案和解析>>
科目: 来源:同步题 题型:实验题

查看答案和解析>>
科目: 来源:同步题 题型:实验题

查看答案和解析>>
科目: 来源:同步题 题型:实验题
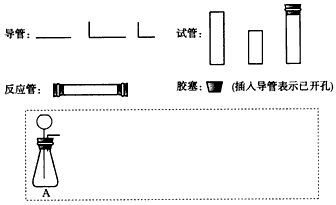

查看答案和解析>>
科目: 来源:同步题 题型:实验题
| 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。 实验一 配制并标定醋酸溶液的浓度 取冰醋酸配制250mL 0.2mol/L的醋酸溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题: (1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、____ 和____。 (2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20. 00mL醋酸溶液进行滴定,几次滴定 消耗NaOH溶液的体积如下: |
 |
| 则该醋酸溶液的准确浓度为____(保留小数点后四位)。 实验二 探究浓度对醋酸电离程度的影响 用pH计测定25℃时不同浓度的醋酸的pH,其结果如下: |
 |
| 回答下列问题: (3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是____。 (4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度___(填“增大”、“减小” 或“不变”)。 实验三 探究温度对醋酸电离程度的影响 (5)请你设计一个实验完成该探究,并简述你的实验方案_______________________________________。 |
查看答案和解析>>
科目: 来源:同步题 题型:实验题
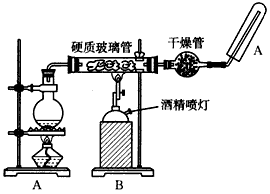
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com