
科目: 来源: 题型:
如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近溶液呈红色。请回答:
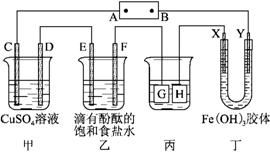 |
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为___________________________________。
(3)现用丙装置给铜件镀银,则H应该是_______________(填“镀层金属”或“镀件”),电镀液是______________溶液。当乙中溶液的pH=13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为___________________。
(4)丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明__________________________,在电场作用下向Y极移动。
查看答案和解析>>
科目: 来源: 题型:
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如下图),每次实验时,通过灵敏电流计测出电子流动方向如下:
|
| 所用金属 | 电子流向 |
| ① | A、Cu | A→Cu |
| ② | C、D | D→C |
| ③ | A、C | C→A |
| ④ | B、Cu | Cu→B |
| ⑤ | …… | …… |
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序是_____________________________。
(2)在①中,Cu片上观察到的现象是:_____________________________;
(3)在②中,溶液中H+向金属片________移动;
(4)在④中,两金属片上均无气泡放出。此时两金属片上的电极反应式分别为:
Cu:____________________________;B:_____________________________;
(5)如果实验⑤用B、D,则导线中电流方向为:_________(填B→D或D→B);
(6)已知反应:Cu+2Fe3+==Cu2++2Fe2+。请用下列试剂和材料,用上图所示装置,将此反应设计成原电池并检验正极产物。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、K3[Fe(CN)6]溶液、双氧水、NaOH溶液
材料:Cu片、Fe片、石墨棒
a、设计电池应选用的试剂和材料是:__________________________________;
b、检验正极产物选用的试剂是_______________________,检验反应的离子方程式:
_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式: 。
(2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。
(4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3 mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列有关说法中,不正确的是:
A.a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中
c(Na+)>c(CN-),则a一定小于b
B.常温下,CH3COONa溶液的pH=8,则c(Na+) -c(CH3COO-)=9.9×10-7mol/L
C.常温下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+) =1×10-8,则溶液中由水电离出的
c(H+) =1×10-11mol/L
D.在0.1 mol/L Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大
查看答案和解析>>
科目: 来源: 题型:
某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ•mol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:
A.该反应属于熵增放热反应,一定能自发进行
B.5 min内H2的平均反应速率为0.1 mol/(L·min)
C.其它条件不变的情况下,加入催化剂可提高CO的转化率
D.若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,
c(CH3OH)=2 mol/L,则a=5.4
查看答案和解析>>
科目: 来源: 题型:
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
科目: 来源: 题型:
常温下,某未知溶液中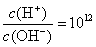 ,且含有大量Al3+和NO
,且含有大量Al3+和NO ,检验此溶液中是否大量存在以下6种离子:①SiO
,检验此溶液中是否大量存在以下6种离子:①SiO 、②NH
、②NH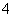 、③Fe2+、④Na+、⑤HCO
、③Fe2+、④Na+、⑤HCO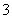 、⑥Cl-,其中不必检验就能加以否定的离子是:
、⑥Cl-,其中不必检验就能加以否定的离子是:
A.①③⑤ B.②③④ C.①②⑥ D.④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
某溶液中大量存在如下五种离子:NO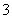 、SO
、SO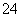 、Fe3+、H+、M,它们的物质的量之比依次为n(NO
、Fe3+、H+、M,它们的物质的量之比依次为n(NO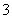 )∶n(SO
)∶n(SO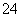 )∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则M可能是:
)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则M可能是:
A.Al3+ B.Mg2+ C.CO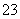 D.Ba2+
D.Ba2+
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是:
 A.碳酸氢钠的水解:HCO3-+ H2O H3O++ CO32-
A.碳酸氢钠的水解:HCO3-+ H2O H3O++ CO32-
B.以硫酸铝和小苏打为主要反应物的泡沫灭火器中的反应原理:
Al3+ +3HCO3- ===Al(OH)3↓+3CO2↑
C.1 mol/L NH4Al(SO4)2溶液中逐滴加入等体积4 mol/L NaOH溶液:
Al3++4OH— === AlO2-+2H2O
D.用惰性电极电解AlCl3溶液:2Cl- + 2H2O 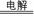 2OH- + H2↑+ Cl2↑
2OH- + H2↑+ Cl2↑
查看答案和解析>>
科目: 来源: 题型:
下列有关实验的说法正确的是:
A.中和滴定时,用待测溶液润洗锥形瓶
B.使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小
C.用酸式滴定管量取12.00 mL高锰酸钾溶液
D.在配制的硫酸亚铁溶液常加入一定量的铁粉和盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com