
科目: 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
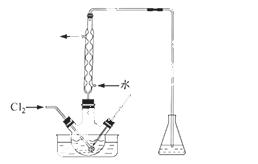
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO32—+2IO3—+2H+ I2+5SO42—+H2O
I2+5SO42—+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3—的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在; 。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液
查看答案和解析>>
科目: 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空 格):
格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了 腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了 (“氧化”或“还原”)反应,其电极反应式是 。
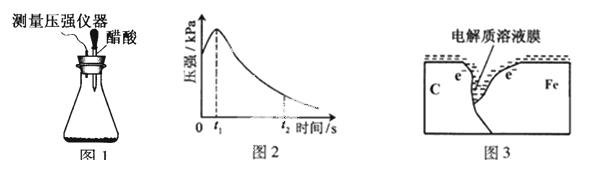
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:  ;
;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目: 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
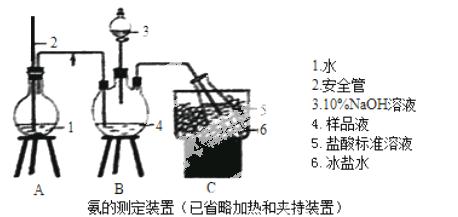
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
查看答案和解析>>
科目: 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
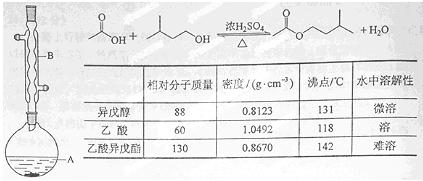
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)装置B的名称是:
(2)在洗涤操作中,第一次水洗的主要目的是: ; 第二次水洗的主要目的是: 。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:
(5)实验中加入少量无水硫酸镁的目的是: 
(6)在蒸馏操作中,仪器选择及安装都正确的是: (填标号)
(7)本实验的产率是:
A、30℅ B、40℅ C、 50℅ D、60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏 (填高或者低)原因是
查看答案和解析>>
科目: 来源: 题型:
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
①步骤3中加氨水后的离子方程式______________________
____________________________________________________。
②步骤4为加快过滤速度,常用____________________ (填过滤方法)。
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入下图所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
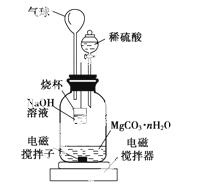
①图中气球的作用是____________________。
②上述反应后期要升温到30 ℃,主要目的是______________。
③设3次实验测得每1.000 g碳酸镁晶须产生的CO2平均值为a mol,则n值为____________________(用含a的表达式表示)。
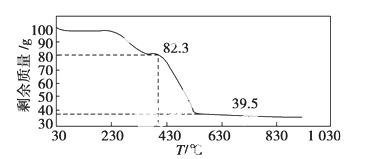
(3)称取100 g上述晶须产品进行热重分析,热重曲线如下图。则该条件下合成的晶须中,n=____________(选填:1、2、3、4、5)。
查看答案和解析>>
科目: 来源: 题型:
工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A ,B 。
(2)实验室提纯粗盐的实验操作依次为:
取样、 、沉淀、 、 、冷却结晶、 、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是______。碳酸化时没有析出碳酸钠晶体,其原因是______。
(4)碳酸化后过滤,滤液D最主要的成分是_____
(填写化学式),检验这一成分的阴离子的具体方法是____。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为: 。滤液D加石灰水前先要加热,原因是 。
(6)产品纯碱中含有碳 酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:________(注明你的表达式中所用的有关符合的含义)。
酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:________(注明你的表达式中所用的有关符合的含义)。
查看答案和解析>>
科目: 来源: 题型:
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量 稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将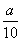 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:
 KMnO4 +
KMnO4 +  FeSO4 +
FeSO4 +  H2SO4 ===
H2SO4 ===  Fe2(SO4)3 +
Fe2(SO4)3 +
 MnSO4 +
MnSO4 +  K2SO4 +
K2SO4 +  H2O
H2O
(2)在滴定实验中不能选择________式滴定管,理由是________
____________________________________________________;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为________和________;
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一________(填“准确”、“不准确”或“不一定准确”),理由是_____________________________;
②方案二________(填“准确”、“不准确”或“不一定准确”),理由是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
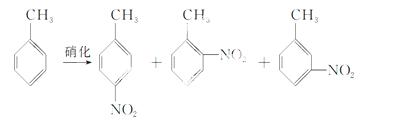
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶剂中,加入乙酸酐(有脱水作用),45 ℃反应1 h。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经 分离提纯得到对硝基甲苯。
分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是_________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_________。
(3)下表给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
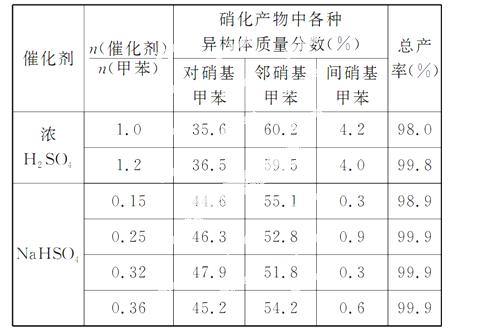
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是__________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有 、 。
查看答案和解析>>
科目: 来源: 题型:
某同学想用实验证明高锰酸钾溶液的紫红色是MnO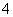 的颜色,而不是K+的颜色。他设计的实验步骤如下,你认为下述实验步骤一定没有意义的是( )
的颜色,而不是K+的颜色。他设计的实验步骤如下,你认为下述实验步骤一定没有意义的是( )
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中K+无色
C.在氯化钾溶液中加入适量锌粉振荡,静置未见明显变化,表示锌与K+不反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO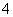 为紫红色
为紫红色
查看答案和解析>>
科目: 来源: 题型:
某学习小组针对如何测定镀锌铁皮镀锌层厚度提出如下一些方案:
方案1.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,通过测量氢气的体积,计算铁皮上的锌的质量。
方案2.将一定质量的镀锌铁皮(W1)投入到足量的FeSO4溶液中,一段时间后,取出铁片,洗净、烘干、称量(W2),计算铁皮上的锌的质量。
方案3.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,再在所得溶液中加入过量的NaOH溶液,过滤、洗涤、烘干、灼烧、沉淀,最后称量。
……
(1)方案2的主要特点是__________,
方案3的主要缺点是__________。
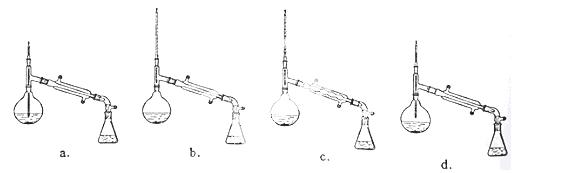
(2)方案1中用到测量气体体积的装置,如图装置中不能用于测量气体体积的装置是 。
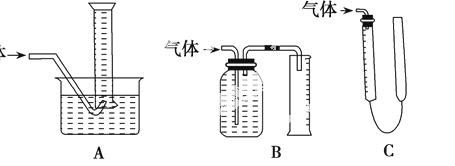
学习小组拟选用C装置作量气装置,则气体收集完毕,准备读数时,应注意:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com