
科目: 来源: 题型:
在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有 g HNO3被还原,则a∶b不可能为 ( )
A.2∶1 B.3∶1 C.4∶1 D.9∶2
查看答案和解析>>
科目: 来源: 题型:
将总物质的量为n mol的钠和铝的混合物(其中钠的物质的量分数为x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L 。下列关系式中正确的是 ( )
。下列关系式中正确的是 ( )
A.x=V/(11.2n) B.0<x≤0.5
C.V=33.6n(1-x) D.11.2n<V≤22.4n
查看答案和解析>>
科目: 来源: 题型:
某硫酸镁和硫酸铝的混合溶液中,c(Mg2+)=2 mol·L-1,c(SO)=6.5 mol·L-1,若将
200 mL此混合液中的Mg2+和Al3+ 分离,至少应加入1.6 mol·L-1的苛性钠溶液( )
A.0.5 L B.1.625 L C.1.8 L D.2 L
查看答案和解析>>
科目: 来源: 题型:
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO的物质的量浓度为6 mol·L-1,则此溶液最多能溶解的铁粉的质量为( )
A.5.6 g B.11.2 g C.22.4 g D.33.6 g
查看答案和解析>>
科目: 来源: 题型:
生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。求:
(1)原混合气体中甲烷的物质的量。
(2)原混合气体中氮气的体积分数。
查看答案和解析>>
科目: 来源: 题型:
超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2===2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L(标准状况),计算反应消耗的KO2的质量。
查看答案和解析>>
科目: 来源: 题型:
氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为
CuCl的质量分数大于96.5%。工业上常通过下列反应 制备CuCl:2CuSO4+Na2SO3+
制备CuCl:2CuSO4+Na2SO3+
2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的Cu SO4·5H2O与H2O的质量之比。
SO4·5H2O与H2O的质量之比。
(2)准确称取所制备的0.250 0 g CuCl样品置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反应的离子方程式为
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
科目: 来源: 题型:
已知:I2+2S2O===S4O+2I-
相关物质的溶度积常数见下表:
| 物质 | CuCl | CuI |
| Ksp | 1.7×10-7 | 1.3×10-12 |
某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是__________________________。
②CuCl2溶液与KI反应的离子方程式为______________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________。
查看答案和解析>>
科目: 来源: 题型:
(1)下列说法不正确的是________(填字母序号)。
A.60周年国庆阅兵车HQE顶级红旗采用全铝车身,铝的氧化物属于碱性氧化物
B.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化
C.英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2
D.液氨、液氯、液态氯化氢都是非电解质
E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
F.化学变化前后原子的种类、数目不变,分子数目也不变
(2)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深,由低级到高级的认识过程。
①1887年阿仑尼乌斯提出电离理论。
②1923年丹麦化学家布朗斯特和英国化学家劳莱提出了质子论。 凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子的水溶液既可看作酸又可看作碱的是________(填字母序号)。
凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子的水溶液既可看作酸又可看作碱的是________(填字母序号)。
A.H2O B.NH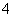 C.OH- D.HCO
C.OH- D.HCO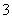 E.CH3COO- F.Cl-
E.CH3COO- F.Cl-
③1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+ + [OH]- —→ HOH
试指出下列两个反应中的酸或碱:
H3BO3+H2O===H++ [B(OH)4]-
[B(OH)4]-
该反应中的碱是________ (填“H3BO3”或“H2O”);
(填“H3BO3”或“H2O”);
CuCl2+4NH3===[Cu(NH3)4]2++2Cl-
该反应中的酸是________(填“CuCl2”或“NH3”)。
查看答案和解析>>
科目: 来源: 题型:
根据物质的组成和性质将下列无机化合物进行了分类。
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②______ | ③NaO ④______ | ⑤Na2SO4 ⑥______ | ⑦SO2 ⑧Na2O | ⑨HCl ⑩_____ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合 适的物质,将化学式分别填在表中②、④、⑥、⑩后面的横线上。
适的物质,将化学式分别填在表中②、④、⑥、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程 式为_______________________________________________________
式为_______________________________________________________ _________________。
_________________。
(3)将⑦通入③的溶液中,反应的离子方程式为______________ ___________________
___________________
________________________________________________________________________。
(4)⑨极易溶于水并电离出氯离子,大多数含氯离子的盐溶于水后也能电离出氯离子。 检验溶液中 氯离子的方法是______________________________________________________________。
氯离子的方法是______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com