
科目: 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.光导纤维的主要成分是SiO2 B.工业上可用铝热反应大规模炼铁
C.电解熔融MgCl2,可制得金属镁 D.SO2常用于纸张等植物纤维的漂白
查看答案和解析>>
科目: 来源: 题型:
(1)某科研小组研究在恒温、恒容(容器容积为2L)下反应:N2(g)+3H2(g)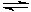 2NH3(g)的变化。初始条件n(H2)=3mol、n(N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数为a%。
2NH3(g)的变化。初始条件n(H2)=3mol、n(N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数为a%。
①此条件下反应的平衡常数K=
②若初始条件为n(H2)=n(N2)=0mol、n(NH3)=2.0mol,反应达到平衡时NH3的转化率为
③若初始条件为n(H2)=6mol、n(N2)=2mol,反应达到平衡时NH3的体积分数 a%(填“>”、“<”、或“=”)。
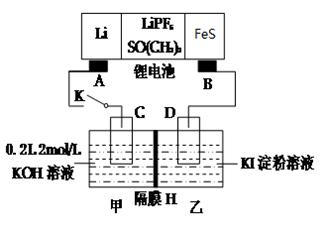
(2)锂电池广泛使用于手表、照相机等电子产品中,具有稳定性好、轻便、环保等优点。右图是以锂电池为电源的电解槽。
①LiPF6作为电池的电解质,可传导Li+导电,已知电池反应为FeS+2Li=Fe+Li2S则A为锂电池的 极,该锂电池的正极反应为 。
②隔膜H为阳离子交换膜,若电解结束后,甲中产生的气体在标准状况下的体积为4.48L,则隔膜H中通过的离子数目为 ,甲中溶液的浓度为 (假设溶液体积不变)。
查看答案和解析>>
科目: 来源: 题型:
姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:
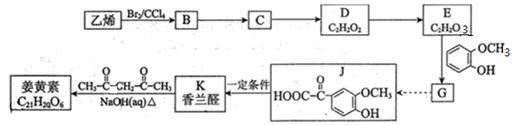
已知:
i.G能与NaHCO3反应放出CO2 ,且1molG能与3molNa反应。
ii.
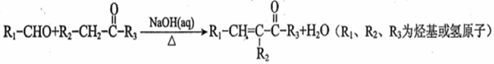
iii.
请回答:
(1)C的名称 D→E的反应类型是
(2)B→C反应的化学方程式是
D与新制Cu(OH)2悬浊液反应的离子方程式是
(3)写出K的结构简式 ;姜黄素的分子中有2个甲基,其结构简式是
(4)写出一种符合下列条件的香兰醛的同分异构体的结构简式
①苯环上的一硝基取代物有2种 ②1 mol该物质水解,最多消耗3 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。

完成下列填空:
(1)装置①中除烧杯外另一种玻璃仪器的名称为 。
(2)先关闭K1、打开K2、再打开分液漏斗旋塞,装置②中产生ClO2的化学方程式为 。
(3)当④中出现晶体后,则装置④中的化学反应方程式为 。然后关闭K2、打开K1,装置①的作用 。
将装置④中的溶液进行下列操作得到的晶体为NaClO2的操作步骤为:
①减压,55℃蒸发结晶; ② ;
③用38-60℃的温水洗涤 ④低于60℃干燥,得到成品。
(4)称取1g所得亚氯酸钠样品于烧杯中,加过量酸化碘化钾溶液,充分反应
(ClO2-+ 4I -+4H+ →2H2O+2I2+Cl-),得到25.00ml混合溶液。再用2.0 mol/L Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),共消耗Na2S2O3 20.00ml。
①滴定时指示剂为 ,达到滴定终点的现象为 。
②该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
硅、镁已发展成当今社会重要的工程材料。
金属镁的冶炼有多种方法,其中之一以白云石(主要成分为CaCO3•MgCO3)为原料,用硅铁合金参与置换得到镁单质,反应工艺流程如下:
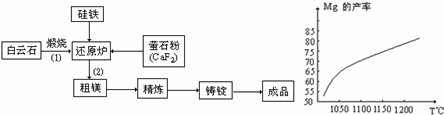
①镁在周期表中的位置为
②萤石粉作为活性剂,可增强冶炼过程中的打渣能力,CaF2的电子式为 ③写出还原炉中高温下发生置换反应的化学方程式 ; 在冶炼过程中反应温度对生成金属镁的影响如上图,从图中分析,该还原反应属于 (填“吸热”或“放热”)反应;
硅烷(SiH4)与甲烷结构相似,二者中较为稳定的是 (填化学式);
下列说法正确的是
A.相同温度下,Mg(OH)2在氨水中的Ksp小于溶解在纯水中的Ksp;
B.玻璃、水泥、陶瓷、光导纤维等都是常见的硅酸盐材料;
C.鉴于MgO和SiO2熔点均较高,故均可用于高温耐火材料
D.向含Fe3+的MgCl2溶液中加入适量MgO ,可有效除去其中的Fe3+
现取白云石100g进行冶炼,已知冶炼过程中,Mg元素的利用率为75%,得成品镁7.2g,则白云石中,CaCO3的质量分数为
查看答案和解析>>
科目: 来源: 题型:
制备晶体硅的热方程式为 SiHCl3(l)+H2(g)=Si(s)+3HCl(g) ΔH=+238KJ/mol,
已知SiHCl3(l)=SiHCl3(g) ΔH=+10KJ/mol,相关键能数据如下表:
| SiHCl3(g) Si—H | SiHCl3(g) Si—Cl | H2(g) H—H | HCl(g) H—Cl | |
| 键能(KJ/mol) | 377 | 360 | 436 | 431 |
则晶体硅的键能为
A.186KJ/mol B.181KJ/mol C.372KJ/mol D.362KJ/mol
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)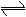
 PCl5(g);5min末达到平衡,有关数据如下表。
PCl5(g);5min末达到平衡,有关数据如下表。
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | C1 | C2 | 0.4 |
下列判断不正确的是
当反应达到平衡状态,容器中Cl2为1.2mol
反应5min内,V(PCl3)=0.08mol/(L·min)
达到平衡后再向容器中充入少量PCl5(g),混合气体的平均摩尔质量将变小。
平衡后移走2.0molPCl3和1.0molCl2,在相同条件下再达到平衡时,C(PCl5)<0.2mol/L
查看答案和解析>>
科目: 来源: 题型:
麦考酚酸是一种有效的免疫抑制剂,其结构简式如下图所示。下列有关麦考酚酸说法正确的是
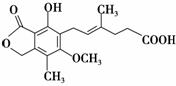 A.分子式为C17H22O6
A.分子式为C17H22O6
B.能与FeCl3溶液发生显色反应,与浓溴水反应最多可消耗2molBr2
C.1 mol麦考酚酸最多能与3 mol NaOH反应
D.在一定条件下可发生加成、加聚、取代、消去反应
查看答案和解析>>
科目: 来源: 题型:
将浓度都为1mol/L的Na2CO3溶液和稀H2SO4按体积比2:1混合,则下列说法正确的是
A.混合溶液的pH<7
B.混合溶液中:c(SO42-)+c(OH-)< c(HCO3-)+c(H2CO3)+c(CO32-)
C.混合溶液中:c(Na+)+c(H+)<2[c(SO42-)+c(CO32-)]
D.混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(SO42-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com