
科目: 来源: 题型:
石墨烯(如图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙).
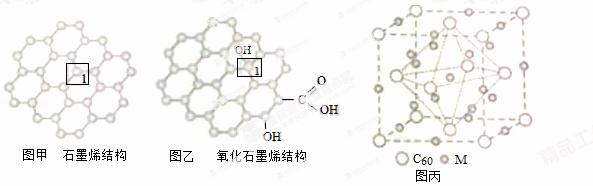
(1)图甲中,1号C与相邻C形成σ键的个数为 _________ .
(2)图乙中,1号C的杂化方式是 _________ ,该C与相邻C形成的键角 _________ (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角.
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有 _________ (填元素符号).
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为 _________ ,该材料的化学式为 _________ .
查看答案和解析>>
科目: 来源: 题型:
碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
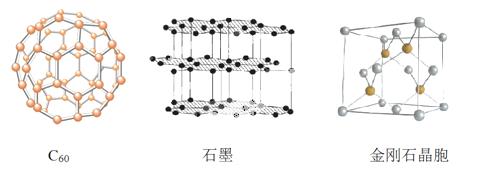
回答下列问题:
(1)金刚石、石墨、C60 .碳纳米管等都是碳元素的单质形式,它们互为_____________。
.碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____、____。
(3)C60属于____晶体,石墨属于____晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的____共价键,而石墨层内的C-C间不仅存在____共价键,还有____键。
(5)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬 球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
查看答案和解析>>
科目: 来源: 题型:
对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是
A.SiX4难水解  B.SiX4是共价化合物
B.SiX4是共价化合物
C.NaX易水解 D.NaX的熔点一般高于SiX4
查看答案和解析>>
科目: 来源: 题型:
已知氯化铝的熔点为190 ℃(2.02×106 Pa),但它在180 ℃即开始升华。
(1)氯化铝是________(填“离子晶体”或“分子晶体”)。
(2)在500 K和1.01×105 Pa时,它的蒸气密度(换算成标准状况时)为11.92 g·L-1,试确定氯化铝在蒸气状态的化学式为________,微粒间的作用力类型有________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判断氯化铝是离子晶体还是分子晶体,你设计的实验是____________________。
查看答案和解析>>
科目: 来源: 题型:
参考下表中物质的熔点,回答有关 问题:
问题:
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤素离子及碱金属离子的________有关,随着________的增大,熔点依次降低。
(2)硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与________有关,随着________增大,________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与________有关,因为_______________,
故前者的熔点远高于后者。
查看答案和解析>>
科目: 来源: 题型:
现有几组物质的熔点( ℃)数据:
| A组 | B组 | C组 | D组 |
| 金刚石:3 550 ℃ | Li:181 ℃ | HF:-83 ℃ | NaCl:801 ℃ |
| 硅晶体:1 410 ℃ | Na:98 ℃ | HCl:-115 ℃ | KCl:776 ℃ |
| 硼晶体:2 300 ℃ | K:64 ℃ | HBr:-89 ℃ | RbCl:718 ℃ |
| 二氧化硅:1 723 ℃ | Rb:39 ℃ | HI:-51 ℃ | CsCl:645 ℃ |
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是____________________。
(2)B组晶体共同的物理性质是________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_________________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为___________。
查看答案和解析>>
科目: 来源: 题型:
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。
回答下列问题:
(1)元素a为________,c为________。
(2)由这些元素形成的双原子分子为________。
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是________,非直线形的是________(写2种)。
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是________,离子晶体的是________,金属晶体的是________,分子晶体的是________(每空填一种)。
(5)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
已知原子序数依次递增的5种非金属元素,A的原子半径在所有原子中最小,B元素组成的化合物种类最多,C的最外层电子数是内层电子数的3倍,且与B同周期,D与B同主族,E在C的下一周期,且是同周期元素中非金属性最强的元素。
回答下列问题:
(1)由A、B、C、E四种元素中的两种元素可形成多种分子,下列分子①BC2 ②BA4 ③A2C2 ④BE4,其中属于极性分子的是________(填序号)。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是_______________。
(3)B、C两元素都能和A元素组成两种常见的溶剂,其分子式为________、________。DE4在前者中的溶解性________(填“大于”或“小于”)在后者中的溶解性。
(4)BA4、BE4和DE4的沸点从高到低的顺序为_________________(填化学式)。
(5)A、C、E三种元素可形成多种含氧酸,如AEC、AEC2、AEC3、AEC4等,以上列举的四种酸其酸性由强到弱的顺序为______________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
(1)①BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
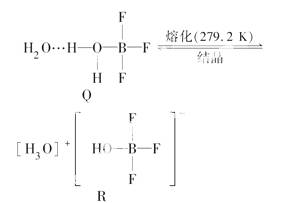
晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②已知苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子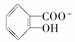 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________________。
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是_________________。
查看答案和解析>>
科目: 来源: 题型:
由于工业发 展,燃烧设备不断增多,设备规模不断增大。这些工厂排放的烟气中都会有大量的
展,燃烧设备不断增多,设备规模不断增大。这些工厂排放的烟气中都会有大量的 SO2废气。据统计,我国1995年工业SO2的排放量为1 396万吨,2006年工业SO2的排放量达到了3 800万吨,由于SO2的污染,我国每年损失高达1 100亿元。
SO2废气。据统计,我国1995年工业SO2的排放量为1 396万吨,2006年工业SO2的排放量达到了3 800万吨,由于SO2的污染,我国每年损失高达1 100亿元。
(1)写出两个工业生产过程中产生SO2的实例:
①________________________________________________________________________、
②________________________________________________________________________。
(2)防治SO2污染可采用的措施有(写出三种):
①________________________________________________________________________、
②________________________________________________________________________、
③___________________ _____________________________________________________。
_____________________________________________________。
(3)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气 液接触,通入空气后生成石膏(CaSO4·2H2O),经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
液接触,通入空气后生成石膏(CaSO4·2H2O),经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:
________________________________________________________________________
________________________________________________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:________________________________________________________________________
_____________ ___________________________________________________________。
___________________________________________________________。
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是__________________。
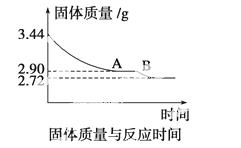
(4)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如下图所示。数据表明当固体的质量为2.72 g后不再改变。求:
①石膏的化学式。②图像中AB段对应化合物的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com