
科目: 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为________,第一电离能最小的元素是________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式),呈现如此递变规律的原因是___________________。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为________________________________________________g·c m-3(保留两位有效数字)。(
m-3(保留两位有效数字)。(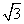 =1.732)
=1.732)
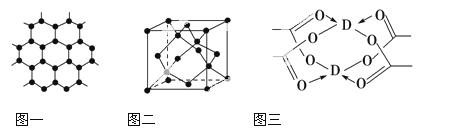
(4)D元素形成的单质,其晶体的堆积模型为________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是________。请写出上述过程的离子方程式:_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
碳、氢、氟、氮、硅等非金属元素与人类的生产 生活息息相关。回答下列问题。
生活息息相关。回答下列问题。
(1)写出硅原子的电子排布式________。C、Si、N的电负性由大到小的顺序是________。
(2)氟化氢水溶液中存在的氢键有________种。
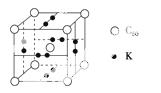
(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为________。
(4)继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点Si60>N60>C60,而破坏分子所需要的能量N60>C60>Si60,其原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为________。
②NO 的空间构型是________(用文字描述)。
的空间构型是________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为________。
②H2O分子中O原子轨道的杂化类型为________。
③1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是_______ _(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
_(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D是常见的不同主族的短周期元素,它们的原子序数逐渐增大。已知其中只有一种是金属元素,C元素原子最外层电子数是D元素原子的最外层电子数的一半,B元素原子的最外层电子数比D元素原子的最外层电子数少2个。E、F也是短周期元素,E与D同主族,F与A同主族。
(1)写出F2E2的电子式:_____________________,
其晶体类型为________,其化学键类型为____________________。
(2)E与D各自形成的氢化物中沸点较高的是____ ____(填化学式),其原因是___________________________,
____(填化学式),其原因是___________________________,
A与B所形成最简单化合物的结构式为________,空间构型为________。
(3)六种元素中的三种组成的易溶于水的酸性物质中,能促进水电离的物质M是___________________
(写化学式,写一个 即可,下同),能抑制水电离的物质N是________。
即可,下同),能抑制水电离的物质N是________。
25 ℃时,pH=a的M溶液中由水电离出的H+浓度与pH=a的N溶液中由水电离出的H+浓度之比为________。
(4)甲、乙、丙分别是B、C、D三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙的用量不同,反应的产物不同。回答下列问题:
①向乙溶液中缓慢滴加过量的丙溶液,过程中发生反应的离子方程式为___________________。
②向甲溶液中缓慢滴加过量的丙溶液,所观察到的实验现象为______________________。
查看答案和解析>>
科目: 来源: 题型:
现有五种短周期元素的性质、用途或原子结构信息如下表:
| 元素 | 元素的性质、用途或原子结构信息 |
| Q | 原子核外有6个电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液常用作肥料,呈弱碱性 |
| Y | 第三周期元素的简单阴离子中离子半径最小 |
| Z | 单质为银白色固体,在空气中燃烧发出黄色火焰 |
请根据表中信息回答下列问题:
(1)Q最简单的气态氢化物分子的空间构型为________。
(2)R单质与X单质在雷电条件下反应产物为________化合物(填“共价”或“离子”),其晶体类型为________。
(3)写出R与Z组成仅含离子键的化合物的化学式:______________,组成的另一物质所含化学键类型为__________________。
(4)工业上用电解Y与Z形成化合物的水溶液制取Y单质,写出该反应的离子方程式:_______________________。
(5)在1.01×105Pa、298 K时,1.4 g QR气体在1.6 g R2气体中完全燃烧,生成QR2气体时放出14.15 kJ热量,写出QR燃烧的热化学方程式:__________________________。
查看答案和解析>>
科目: 来源: 题型:
A、B、M、D、E是原子序数依次增大的五种短周期元素。A元素的一种原子中不含中子。B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍。试回答:
(1)将D、E的元素符号分别填在相应的空格内。
(2)在B、M、D、E四种元素的最简单氢化物中,沸点最高的是__________(填化学式)B、M的最简单氢化物的空间构型分别为________、____ ____。
____。
(3)A、B、M、D可组成多种18电子分子,其中两种的结构可分别表示为A2M—MA2和BA3—MA2,请根据这两种分子的结构特点再写出2种具有18电子的有机物的结构简式__________、__________(用元素符号表示)。
(4)D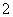 存在于人体中,能使人过早衰老,但在催化剂存在下很快转化为A2D2、D2等物质,该转化过程可用离子方程式表示为______+______H2O
存在于人体中,能使人过早衰老,但在催化剂存在下很快转化为A2D2、D2等物质,该转化过程可用离子方程式表示为______+______H2O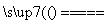 ______+________+______,其中A2D2中所含化学键类型有________。
______+________+______,其中A2D2中所含化学键类型有________。
(5)由C原子构成C60,其晶体类型为________,由M最高价氧化物与其气态氢化物反应生成的物质为________,其晶体类型为________。
查看答案和解析>>
科目: 来源: 题型:
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
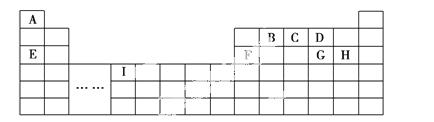
(1)写出由上述两种元素组成X2Y2型化合物的化学式分别为____________,其晶体类型分别为__________________。
(2)B、C、D的氢化物中,沸点最高的氢化物的结构式是____________,富含沸点最低的氢化物的矿物的名称是____________。
(3)上述元素形成的单质中,属于原子晶体的是________(填名称),其空间构型为________________。
(4)写出由上述元素中相同的四种元素组成的两种化合物的水溶液发生反应的离子方程式:_____________________。
(5)写出由上述元素中的三种形成的既含有离子键又含有极性共价键的化合物的电子式:____________________(任写两个)。
查看答案和解析>>
科目: 来源: 题型:
原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式:_____________________,
其中含有的化学键是______________,属于晶体类型为________。
(2)用电子式表示Y2O的形成过程______________________。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是________(填化学式)。
(4)XH3、H2Z和HW三种化合物,其空间构型分别为________、________、________。其中一种与另外两种都能反应的是______________(填化学式),其生成物晶体类型分别属于________、________。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
(1)A原子核外比X原子多3个电子,A的原子结构示意图是____________,X的氧化物晶体中含有化学键类型是____________,含1 mol X的氧化物晶体中含有共价键数目为________。
(2)Z与钙离子组成的化合物的电子式为_________________,
其晶体类型为____________。
(3)14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式______________________。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略)

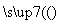

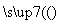

①写出丁在高温下与水蒸气反应的化学方程式________________________。
②组成W的元素的简单氢化物极易溶于水的主要原因是
______________________,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH溶液,其负极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com