
科目: 来源: 题型:
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G—→Q+NaCl
②Q+H2O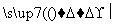 X+H2
X+H2
③Y+NaOH—→G+Q+H2O
④Z+NaOH—→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是 ( )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
查看答案和解析>>
科目: 来源: 题型:
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-)
查看答案和解析>>
科目: 来源: 题型:
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程
的反应式: NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若 产生0.2mol气体,则转移电子的物质的量是 mol。
产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
查看答案和解析>>
科目: 来源: 题型:
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:(a) Ni2+ + H2PO2-+ →  Ni++ H2PO3-+
Ni++ H2PO3-+
请在答题卡上写出并配平反应式(a)。
查看答案和解析>>
科目: 来源: 题型:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2 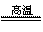 Si3N4 + CO
Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
查看答案和解析>>
科目: 来源: 题型:
工业上焙烧明矾[ KAl(SO4)2·12H2O]的化学方程式为:
4 KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4
B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-)
C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M= 474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2
NaAlO2+3Ni(OH)2
查看答案和解析>>
科目: 来源: 题型:
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中 ,溶液内发生反应的离子方程式,其中不正确的是
,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2-+Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________________________(用对应的元素符号表示);基态D原子的电子排布式为
______________________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
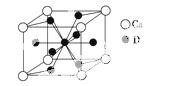
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com