
科目: 来源: 题型:
某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO
呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。
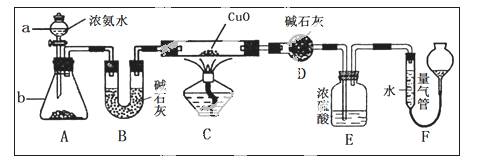
请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ →Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:
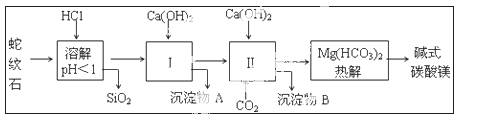
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入 (填加入物质的化学式),然后 (依此填写实验操作名称)。物质循环使用,能节约资源。上述实验中,可以循环使用的物质是 (填写物质的化学式)。
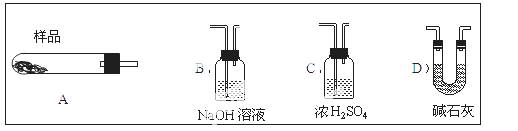
(4)现设计实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值。请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③ ,④ ,⑤MgO称量。
(5)从下列仪器(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置 (选择仪器代号,可重复使用,用“A→B→……→”表示)
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中a= ,b= ,c= 。
查看答案和解析>>
科目: 来源: 题型:
有几个实验小组的同学,利用右
图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装
液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检
验其性质。
请你回答以下各组同学在交流实验设计方案中提出的问题:
Ⅰ.(1)若a:浓盐酸;b:高锰酸钾(其氧化性比二氧化锰强很多);c:红色鲜花瓣。在实验过程中c中的现象_____________________________________________________________。
d装置中盛放药品的作用是______________________________,请写出d中反应的离子方程式: ___________________________________________________________________。
(2)若a:稀盐酸;b:贝壳粉;c:饱和碳酸钠溶液;d:饱和Na2SiO3溶液。在实验过
程中,c中出现的现象是____________________。d中现象是____________,这说明
________________________________________________________________________。
Ⅱ.你认为四组同学在制取气体之前都应进行的操作是________________。你还可以利用此装置的a和b两部分制取的气体有(只写一种)_________________。
查看答案和解析>>
科目: 来源: 题型:
为验证氧化性:Cl2>Fe3+>SO2,某
小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
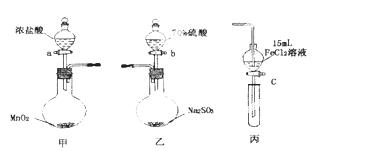
实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
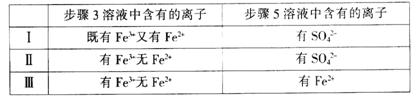
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
查看答案和解析>>
科目: 来源: 题型:
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下:
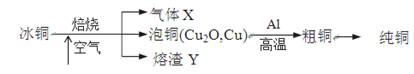
请回答下列问题:
(1)气体X是 。
(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②装置C的作用是________________。
③在点燃D处的酒精灯前,应进行的操作是__________________。

(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。
限选试剂: 3 mol·L-1H2SO4、6 mol·L-1HNO3、3% H2O2、0.01 mol·L-1KMnO4、20% KSCN。 
 。
。
(4)写出泡铜冶炼粗铜反应的化学方程式 。
(5)根据限选材料画出用粗铜提炼纯铜的装置图,并进行必要的标注。
限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。
查看答案和解析>>
科目: 来源: 题型:
实验室用浓盐酸和MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应:
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2 +5CaCl2+6H2O

现有三个同学分别设计的三套实验装置,如图所示:
(1)请从a.不容量控制反应速率;b.容量控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染环境等几个方面对上述甲、乙、丙三套装置的优缺点做出评析,并选择符合题目要求的选项填在空格内。
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。请从上述装置中选取合理的组成部分,组装成一套较完善的实验装置,装置的各部分的连接顺序(按气流从左到右的方向)是 。
(3)实验中若用12mol·L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是 0.15mol(填“大于”、“小于”或“等于”),其原因是(假定各步反应均无产物损耗,且无副反应发生) 。
查看答案和解析>>
科目: 来源: 题型:
某学习小组做以下实验:在溴水中加入足量乙醛溶液,充分反应,溴水褪色。为探究褪色的原因,他们提出了如下三种猜想:
①溴水中的Br2可能与乙醛发生取代反应
②乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应
③乙醛具有还原性,溴水可能将乙醛氧化为乙酸,Br2转化为HBr
为探究哪一种猜想正确,一研究小组提出了如下两种方案:
方案(一):检验褪色后溶液的酸碱性,确定其发生哪类反应
方案(二):测定反应前溴水中Br2的物质的量和反应后 Br-的物质的量确定其发生哪类反应
(1)方案(一)是 否可行?______ (填“可行”或“
否可行?______ (填“可行”或“ 不可行”) ;理由是:
不可行”) ;理由是: 
(2)假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)= mol, 则说明溴水与乙醛发生了取代反应
若测得反应后n(Br-)= mol,则说明溴水与 乙醛发生了加成反应
乙醛发生了加成反应
 若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸
若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸
(3)向含Br2 0.005mol的溴水中加入足量乙醛使其褪色,然后加过量的AgNO3溶液,过滤、洗涤、干燥、称量,得到固体1.88克。已知CH3COOAg易溶于水,通过计算,判断溴水与乙 醛发生的反应为 (填猜想序号),溴水与乙醛反应的化学方程式为
醛发生的反应为 (填猜想序号),溴水与乙醛反应的化学方程式为
(4 ) 已知柠檬醛的结构简式为
) 已知柠檬醛的结构简式为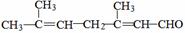 ,若要检验出其中的碳碳双键,其方法是 。
,若要检验出其中的碳碳双键,其方法是 。
查看答案和解析>>
科目: 来源: 题型:
肉桂酸甲酯是一种常用的调制具有水果香味的食用香精。下图是由A合成聚肉桂酸甲酯等有机物的合成信息:
已知:

②F为由两分子D间反应形成含有三个六元环的酯;

请回答下列问题:
(1)D→G的反应类 型是________________;G→H的反应类型是________________;
型是________________;G→H的反应类型是________________;
(2)D转化为E的化学方程式是______________________________________________;
(3)下列物质的结构简式:A_______________________________;F________________;
(4)符合以下条件的D的同分异构体有_____种,写出其中一种的结构简式________________。
①苯环上有2种氢,3个取代基; ②能发生银镜反应; ③遇FeCl3溶液显色。
(5)请用合成路线流程图表示 →G的合成线路,并注明反应条件。
→G的合成线路,并注明反应条件。
提示:① 氧化羟基的条件足以氧化有机分子中的碳碳双键;
氧化羟基的条件足以氧化有机分子中的碳碳双键;
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
查看答案和解析>>
科目: 来源: 题型:
已知有机物A由C、H、O三种元素组成,取1 mol 充分燃烧生成4 mol CO2 和54 g H2O,A 的相对分子质量为86。回答下列问题:
(1)A物质的分子式是 。
(2)A物质符合下列条件:
① 能与Br2的CCl4溶液发生化学反应使其褪色;② 能与NaHCO3溶液反应放出CO2气体;
符合上述要求的A有多种,其结构简式分别是 。
(不要求顺反异构与立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com