
科目: 来源: 题型:
某溶液 中含有较大量的Cl-、CO
中含有较大量的Cl-、CO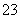 、OH-三种离子,如果只取一次该溶液分别将三种离子检验出来,下列添加试剂顺序正确的是 ( )
、OH-三种离子,如果只取一次该溶液分别将三种离子检验出来,下列添加试剂顺序正确的是 ( )
A.先加Mg(NO3)2,再加Ba(NO3)2,最后加AgNO3
B.先加Ba(NO3)2,再加AgNO3,最后加Mg(NO3)2
C.先加AgNO3,再加Ba(NO3)2,最后加Mg(NO3)2
D.先加Ba(NO3)2,再加Mg(NO3)2最后加AgNO3
查看答案和解析>>
科目: 来源: 题型:
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 溴水 | 蒸馏 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | O2 | 点燃 |
| D | 淀粉(KCl) | H2O | 置于半透膜袋中漂洗 |
查看答案和解析>>
科目: 来源: 题型:
下列有关实验的做法错误的是
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体
C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl-
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
查看答案和解析>>
科目: 来源: 题型:
下列除去杂质的方法正确的是 ( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
查看答案和解析>>
科目: 来源: 题型:
下列实验能达到预期目的的是 ( )
①用蒸馏的方法可将海水淡化 ②将混合气体通过盛有品红溶液的洗气瓶,可除去CO2中的SO2 ③向溶液中滴入盐酸酸化的氯化钡溶液可检验溶液中是否含有SO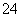 ④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2
④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2
A.①② B.①④
C.②③ D.③④
查看答案和解析>>
科目: 来源: 题型:
下列实验操作或原理不正确的是 ( )
A.蒸馏操作时,温度计水银球的位置应在蒸馏烧瓶的支管口处
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较
查看答案和解析>>
科目: 来源: 题型:
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进
行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
|
 2Fe2O3+8SO2
2Fe2O3+8SO2 
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

|
III、测定铁元素含量的实验步骤如图所示。


问题讨论:
(1)I中,甲瓶内所盛试剂是____溶液。乙瓶内发生反应的离子方程式为____。
(2)II中,乙瓶加入H2O2溶液时反应的离子方程式为_____________________。
(3)该黄铁矿中硫元素的质量分数为_______________________。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有____________________________________________。
(5)III的步骤④中,表示滴定已达终点的现象是
(6)Ⅲ的步骤④进行了三次平行实验,测得消耗KMnO4溶液体积分别为24.98mL、24.80mL、25.02mL(KMnO4被还原为Mn2+)。根据上述数据,可计算出该黄铁矿样品铁元素的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应只生成CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成一种Cu(OH)2沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的离子反应方程式为: _ ;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为 ①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
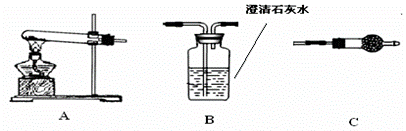

(1)各装置连接顺序为 


 。
。
(2)装置C中装有的试剂名称是 。
(3)按你的装置连接顺序,甲的猜想是正确的,则可通过________________________现象来说明甲的猜想是正确的。
Ⅲ.若CuCO3和Cu(OH)2两者都有,丙同学通过装置Ⅰ进行定量分析来测定其组成。

(1)实验有关操作为:①往锥形瓶中放入适量的样品:②从分液漏斗往锥形瓶中加入过量的稀硫酸;③检验装置的气密性;④测定收集到水的体积。
正确的操作顺序为____________________。
(2)广口瓶中水的上面覆盖了一层植物油,若瓶中的液体没有装满(上方留有少量空间),实验测得CO2的体积将___________(填偏大、偏小或不变)。
(3)若实验中测得样品的质量为wg,气体的体积为aL(标况下),则样品中CuCO3的质量分数为___________(CuCO3的式量为124)。
(4)丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大。建议改用图中的Ⅱ、III装置进行实验。只需进行简单而又必要的数据测定,可比较准确地确定样品中CuCO3的质量分数,较合理的装置_______(填代号)。但是丁同学的装置仍然有缺陷,所测结果将偏高或偏低__________。理由是___________________________
查看答案和解析>>
科目: 来源: 题型:
根据要求完成下列实验。(a、b 为弹簧夹,其他装置略去)
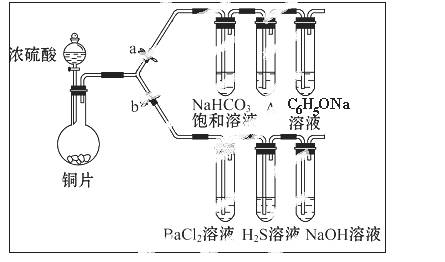
(一)验证酸性的相对强弱:碳酸>苯酚。(已知酸性:亚硫酸 >碳酸)
(1)铜与浓硫酸反应的化学方程式是_________________________________________,
装置A中的足量的试剂是 。
(2)连接仪器、 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。能说明碳酸的酸性比苯酚酸性强的实验现象是:____________________________。
(二)验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a。能验证SO2具有氧化性的化学方程式是_______________________。
(4)若过量的SO2通入NaOH溶液中,其化学方程式是:____________________________。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式分别是__________________,_________________。
(6)写出其中SO2 显示还原性并生成白色沉淀的总的离子方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com