
科目: 来源:专项题 题型:实验题

查看答案和解析>>
科目: 来源:0119 月考题 题型:实验题
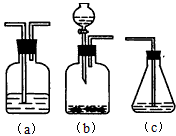
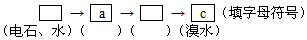
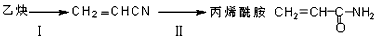
查看答案和解析>>
科目: 来源:月考题 题型:实验题

查看答案和解析>>
科目: 来源:期末题 题型:实验题
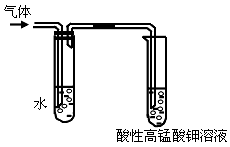
查看答案和解析>>
科目: 来源:浙江省高考真题 题型:实验题
 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
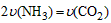
 NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。 
查看答案和解析>>
科目: 来源:安徽省高考真题 题型:实验题
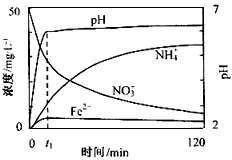

查看答案和解析>>
科目: 来源:同步题 题型:实验题

查看答案和解析>>
科目: 来源:同步题 题型:实验题

查看答案和解析>>
科目: 来源:同步题 题型:实验题


查看答案和解析>>
科目: 来源:同步题 题型:实验题
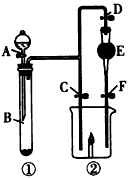
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com