
科目: 来源: 题型:
下列叙述中正确的是( )
A.氧化剂中的每一种元素在反应中都得到电子
B.还原剂在同一反应中既可以是反应物,也可以是生成物
C.失电子多的还原剂,还原性不一定强
D.阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目: 来源: 题型:
某学生利用以下装置探宄氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
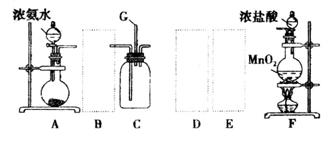
请回答下列问题:
(1)装置A中的烧瓶内固体可选用_______________(选填以下选项的代号)。
A.碱石灰 B.五氧化二磷 C.二氧化硅 D.生石灰 E.固体烧碱
(2)装置F中发生反应的离子方程式:_______________________。
(3)虚线框内应添加必要的除杂装置,请从下图的备选装置中选择,并将编号填入下列空格:
B__________,D__________,E__________。(均填编号)

(4)装置C内出现浓厚的白烟并在容器内壁凝结,写出反应的化学方程式并配平:
__________________________________________。
(5)从装置C的出气管口处逸出的尾气可能会污染环境,用装有______试剂的洗气瓶处理。
查看答案和解析>>
科目: 来源: 题型:
掌握物质之间的转化,是学习元素化合物知识的基础。
(I)(1)中学常见的某反应的化学方程式为:
A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式____________;
②某探究性学习小组利用右图中所列装置实验,证明上述反应中有C、D生成。则b瓶溶液的作用是_________,该溶液还可以用_____________试剂代替。
③装置d中所盛溶液是__________。
(II)下列框图所示的物质转化关系中,甲、乙、丙是常见的气体单质。气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略
 去)。
去)。
请回答下列问题:
(1)写出C的电子式:___________________________。
(2)E是_______化合物(填“共价”或“离子”,含有的化学键为__________________。
(3)写出B和丙生成A的离子反应方程式_________________________________________。
(4)工业上可用C的浓溶液吸收某些工厂尾气中的SO2,写出反应成酸式盐的离子方程式:
______________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为__________。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成+1价阳离子,每个该离子中的电子数是________,元素Z的最高价含氧酸的稀溶液与金属银反应的离子方程式为_______________________________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式
_____________________________________________________________________;
元素X的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式____________________________。
(5)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是________(用酸的分子式表示)。
查看答案和解析>>
科目: 来源: 题型:
化学基本概念、化学用语是中学化学学习的重要内容之一。
I:氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:NO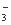 +4H++3e
+4H++3e ==NO+2H2O。
==NO+2H2O。
下列四种物质:KMnO4,Na2CO3,Na2SO3,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生。
(1)被还原的元素是___________;还原剂是_________。
(2)写出并配平该氧化还原反应的离子方程式:_________________。
(3)若反应后,还原产物的化合价降低,而其他物质价态保持不变,则反应中氧化剂与还原剂的物质的量之比将_______(填“增大”“不变”减小”或“不能确定”)。
II:实验室需要用Na2CO3 l0H2O配制0.10mol/L Na2CO3溶液240mL。
l0H2O配制0.10mol/L Na2CO3溶液240mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、__________、___________。
(2)计算。
(3)称量。配制该溶液需称取Na2CO3 10H2O晶体_________g。
10H2O晶体_________g。
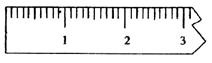 ①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
 ②称量过程中Na2CO3
②称量过程中Na2CO3 10H2O晶体应放于天平的________(填“左盘”或“右盘”)。
10H2O晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________
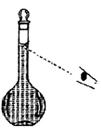
(5)转移、洗涤。 (6)定容,摇匀。
若观察定容时液面情况如右图所示,所配溶液的浓度会_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
1.92gCu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积(标况)为( )
A. 168 mL B.504 mL C.336 mL D.448 mL
查看答案和解析>>
科目: 来源: 题型:
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
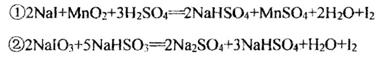
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO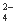 >IO
>IO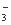 >I2
>I2
D反应①、②中生成等量的I2时转移电子数比为1:5
查看答案和解析>>
科目: 来源: 题型:
下列关于某溶液所含离子检验的方法和结论正确的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
B.通入少量Cl2后,溶液变为黄色,再加入淀粉溶液后,溶液变蓝,说明有I
C.加入盐酸产生能使澄清灰水变浑浊的气体,原溶液中一定有CO3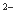 或SO
或SO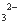
D.往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO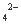
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com