
科目: 来源: 题型:
下列叙述正确的是( )
A.同周期元素中ⅦA族元素的相对原子质量最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.同周期中ⅠA族元素的金属性比ⅡA族元素的金属性强
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
查看答案和解析>>
科目: 来源: 题型:
已知33As、35Br位于同一周期。下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目: 来源: 题型:
X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
查看答案和解析>>
科目: 来源: 题型:
X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Y与Z两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径,X、Y、Z元素原子序数的关系是( )
A.X>Y>Z B.Y>X>Z
C.Z>X>Y D.Z>Y>X
查看答案和解析>>
科目: 来源: 题型:
A元素原子L层比B元素的原子L层少3个电子,B元素原子核外电子数比A元素原子电子总数多5个,则A、B可形成( )
A.AB B.A2B
C.B3A2 D.B2A3
查看答案和解析>>
科目: 来源: 题型:
下列叙述不正确的是( )
A.原子核外每层最多容纳的电子数为2n2个(n为电子层)
B.同一原子核外的M层上的电子数一定比L层上的电子数多
C.如果原子只有一个电子层,该原子的质子数不超过2个
D.1~18号元素,每层电子数都满足2n2个电子的元素只有2种
查看答案和解析>>
科目: 来源: 题型:
(1)已知:2NO2(g)N2O4(g) ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应 2NO2(g)N2O4(g)达到平衡。
其他条件不变时,下列措施能提高NO2的转化率的是________(填字母)。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(2)17 ℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030 0 mol·L-1、c(N2O4)=0.012 0 mol·L-1。计算反应2NO2(g)N2O4(g)的平衡常数K。
(3)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2的混合气体(17 ℃、1.01×105Pa),理论上至少需消耗Cu多少克?
查看答案和解析>>
科目: 来源: 题型:
某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表所示。
| 实验序号 | 时间浓度温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800°C | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800°C | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800°C | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820°C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列空白:
(1)在实验1中,反应在10 min~20 min内平均反应速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20 min就达到平衡状态,可推测实验2中还隐含的条件是______________________。
(3)设实验3的反应速率为ν3,实验1的反应速率为ν1,则ν3________ν1(填“>”“=”或“<”),且c3________1.0 mol·L-1(填“>”“=”或“<”)。
(4)比较实验4和实验1,可推测该反应是________(填“吸热”“放热”)反应;理由是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
在450 ℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
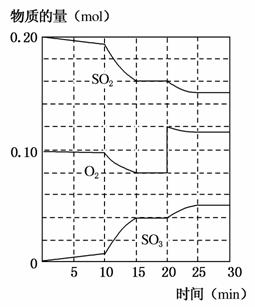
2SO2(g)+O2(g)2SO3(g) ΔH=-190 kJ·mol-1
(1)该反应500 ℃时的平衡常数________450 ℃时的平衡常数(填“>”、“<”或“=”)。
(2)450 ℃时,在一2 L密闭容器中,将二氧化硫和氧化混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________________。
(3)据图判断,反应进行至20 min时,曲线发生变化的原因是__________________(用文字表达),10 min到15 min的曲线变化的原因可能是________(填字母)。
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是________。(填字母)
a.向装置中再充入N2
b.向装置中再充入O2
c.改变反应的催化剂
d.升高温度
(5)利用图中数据计算450 ℃时反应进行至15 min时,SO2的平衡转化率为:________。
(6)450 ℃时,另一2 L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(SO2)=0.4 mol,n(O2)=0.2 mol,n(SO3)=0.8 mol,则此时该反应向________进行(填“正反应方向”“逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com