
科目: 来源: 题型:
某有机物A是农药生产中的一种中间体,其结构简式如下。

下列叙述中正确的是( )
A.有机物A属于芳香烃
B.有机物A可以与Br2的CCl4溶液发生加成反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1molA与足量的NaOH溶液反应,最多可以消耗3molNaOH
查看答案和解析>>
科目: 来源: 题型:
核黄素又称维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为:
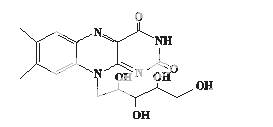
已知: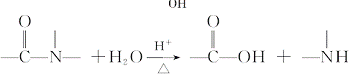
有关核黄素的下列说法中,不正确的是( )
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发 生酯化反应
生酯化反应
查看答案和解析>>
科目: 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶
液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是___________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有___________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液 分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
查看答案和解析>>
科目: 来源: 题型:
某校高三同学高考前重做以下两个课本实
验,请你回答实验过程中的相关问题:
 (1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进
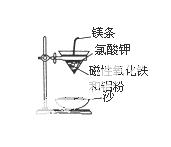 行铝热反应,将反应后所得“铁块”溶于盐酸,向反应后的溶液
行铝热反应,将反应后所得“铁块”溶于盐酸,向反应后的溶液
中滴加K SCN溶液,发现溶液变血红色。
SCN溶液,发现溶液变血红色。
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的
磁性氧化铁外,还有一种可能原因是  。
。
② 若要证明反应所得“铁块”中含有金属铝,可用 (填化学式)溶液,所发生反应的离子方程式为 。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H+ + 4I-+ O2 = 2I2 + 2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A—C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 / mL | 出现蓝色时间 /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
①为确保A组实验在39℃下进行,应采用的控温操作方法是 。
②A—C三组实验时,都加入了5mL水,其目的是  。
。
③B组实验中“没出现蓝色”,原因是 。
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标。
⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结
论 。
查看答案和解析>>
科目: 来源: 题型:
MnO2是中学化学中常见的一种试剂,可作氧化剂和催化剂。某兴趣小组通过实验对MnO2
的性质进行了一系列的研究。
(1)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1 g·cm-3)配制浓度为3%的H2O2溶液(密度近似为1 g·cm-3)100 mL。简述其配制方法:______________________________。
(2)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是__________。
A.把MnO2固体加入到FeS O4溶液中,再加入KSCN溶液,观察溶液是否变血红
O4溶液中,再加入KSCN溶液,观察溶液是否变血红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变血红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(3)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验:
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2 mol·L-1 NaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1 mol·L-1硫酸 | 迅速变棕褐色 |
从上述对比实验中,可以得出的结论是_____________________________________。
写出在酸性条件下,MnO2氧化I-的离子方程式________________________________。
(4)利用二氧化锰的氧化性,让其与浓盐酸反应制取氯气,下列仪器可作为该反应的反应容器的是__________(填序号)。
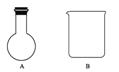
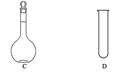
查看答案和解析>>
科目: 来源: 题型:
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ. AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4溶液。
⑴请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入 ,振荡 |
| 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴KMnO4溶液,振荡 |
| 存在Fe2+ |
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
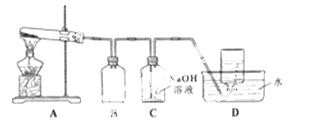
Ⅱ.⑵装置B的作用是 。
。
⑶经小组讨论并验证该无色气体为O2,其验证方法是 。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体, 进行了如下实验。
进行了如下实验。
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为 。
【实验拓展】取2.0g AgNO3样品充分受热分解,共收集到标况下气体的体积为336mL,则样品中AgNO3的百分含量为 。
查看答案和解析>>
科目: 来源: 题型:
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为
。
② 乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是
乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是
。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
 为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKM nO4标准溶液装入50mL 中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
nO4标准溶液装入50mL 中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
查看答案和解析>>
科目: 来源: 题型:
工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO (aq)PbCO3(s)+SO
(aq)PbCO3(s)+SO (aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:K=____________________________________。
(2)室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在________溶液中PbSO 4转化率较大,理由是___________________________。
4转化率较大,理由是___________________________。
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:_____________________________________________________________;
假设三:____________________________________ _________________________。
_________________________。
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成下表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,…… |
②定量研究:取26.7 mg的干燥样品,加热,测得固体质量随温度的变化关系如下图:

某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
__________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知有机物之间能发下如下反应:酸化
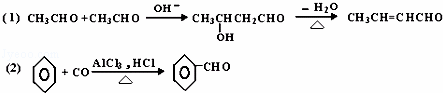
下列有机化合物A~H有如下图所示的转化关系:
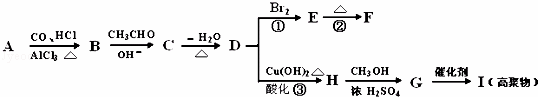
其中,化合物D的分子式为C10H10O,其苯环上的一氯代物只有两种;F的分子式为C10H8O,且所有碳原子在同一平面上.请回答下列问题:
(1)写出下列物质的结构简式:A ;I .
(2)反应①的反应类型为 ;反应②的条件为 .化合物F的核磁共振氢谱(1H﹣NMR)显示有 个峰.
(3)写出下列反应的化学方程式:CH3CHO与足量HCHO反应 .反应③ .
(4)化合物D有多种同分异构体,满足下列条件的有6种(一个碳原子上不可能两个双键):①属于酚类;②结构中除苯环外无其他环;③苯环上只有两种互为对位的取代基.
其中的三种结构简式如下:

请写出其它三种结构简式 、 、 .
查看答案和解析>>
科目: 来源: 题型:
Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题:
(1)Cr元素(核电荷数为24)的基态原子电子排布式为 ,这一排布方式符合 (填原理或规则),比较Fe和 Mn的各级电离能后发现,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子 (填“难”或“易”).(每空两分,共6分)
(2)过渡元素有着与主族元素不同的价电子构型,其中外围电子构型为4f75d16s2的元素在周期表中处在 族,该族元素共有 种.
(3)某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应(巨磁电阻效应).用A、B、O表示这类特殊晶体的化学式: .
(4)有一种蓝色晶体可表示为:[KxFey(CN)z],研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,K+位于上述晶胞体心,且K+空缺率为50%(体心中没有K+的占总体心的百分比),其晶体中的阴离子晶胞结构如图2所示,该晶体的化学式可表示为
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com