
科目: 来源: 题型:
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是 ( )
A.惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
B.标准状况下,4.0 g CH4中含有共价键的数目为NA
C.1 mol C12发生化学反应,转移的电子数必为2NA
D.在反应KIO3+6HI =KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA
查看答案和解析>>
科目: 来源: 题型:
化学与社会、生产、生活密切相关,下列说法正确的是 ( )
A.澳大利亚学者研究发现,夏季给鸡喂食碳酸水会使蛋壳变厚
B.陶瓷、水泥及所有玻璃都是硅酸盐产品
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.Cl2有漂白性,所以用Cl2可与石灰乳反应制备含氯消毒剂
查看答案和解析>>
科目: 来源: 题型:
碱式碳酸铝镁
[ MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和____________。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率( ×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
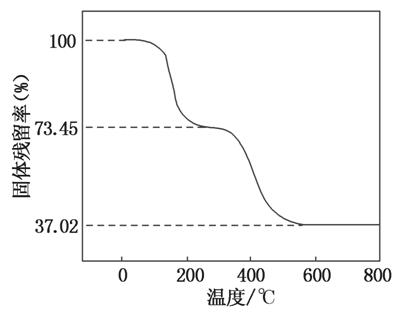
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)n(CO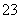 )(写出计算过程)。
)(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
用FeCl3酸性溶液脱除H2S后的溶液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是___________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式:__________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法___________________________。
③与Ⅱ对比,得出的结论(写出两点)___________________。
查看答案和解析>>
科目: 来源: 题型:
根据Fe3++AgFe2++Ag+,可用Fe3+做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是________(用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是________(填选项字母)。
a.铁元素质量减小 b.c(Fe3+)减小
c.c(Cl-)不变
(3)用Fe(NO3)3溶液洗银后,某同学欲从洗银废液(含Fe3+、Fe2+、Ag+、NO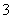 )中回收银,设计了如下路线:
)中回收银,设计了如下路线:
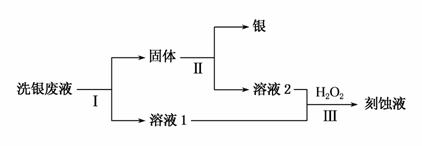
①过程Ⅰ中反应的离子方程式是__________________________。
②过程Ⅱ中加入的试剂可以是_____________________。
③过程Ⅲ中发生反应的离子方程式为________________________。
查看答案和解析>>
科目: 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期,第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)Pb O2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________。
O2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为______________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解___,阴极上观察到的现象是________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为_______,这样做的主要缺点是________。
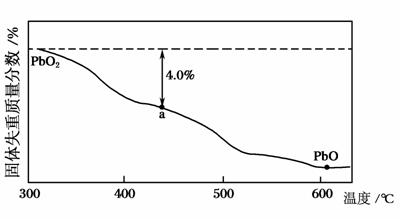
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即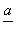 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和mn值________。
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和mn值________。
查看答案和解析>>
科目: 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目: 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。下列分析错误的是( )
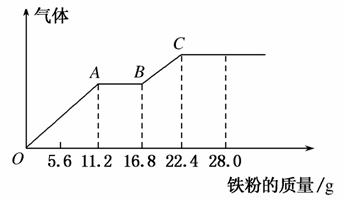
A.AB段的反应为:Fe+2Fe3+===3Fe2+
B.第二份溶液中最终溶质为FeSO4
C.混合酸中NO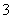 物质的量为0.4 mol
物质的量为0.4 mol
D.混合酸中H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO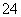 、NO
、NO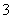 、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72 g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO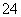 、NO
、NO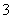
查看答案和解析>>
科目: 来源: 题型:
下列有关物质性质的描述和该性质的应用均正确的是( )
A.FeCl3具有氧化性,用FeCl3溶液刻蚀印刷电路板
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.过氧化钠只有 氧化性,用过氧化钠为潜水艇舱提供氧气
氧化性,用过氧化钠为潜水艇舱提供氧气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com