
科目: 来源: 题型:
已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
查看答案和解析>>
科目: 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目: 来源: 题型:
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+ O2(g)= 2NO(g) △H= + 180.5 kJ/mol
2H2(g)+ O2(g)= 2H2O(g) △H= - 483.6 kJ/mol
则反应2H2(g)+ 2NO(g) = 2H2O(g) + N2(g) △H=________。
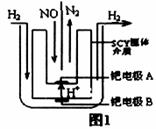 (2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。钯电极A为____极,电极反应式为_______________。
(3)污染物NO、NO2也可以用烧碱溶液吸收,生成物中无气体,该反应的离子方程式为______________________________________________。只有NO2也能与NaOH溶液反应,生成NaNO2 和NaNO3 。现用某烧碱溶液完全吸收n mol NO2和m mol NO组成的混合气体,若所得溶液中c(NO3-): c(NO2-) = 1:9,则原混合气体中NO2和NO的物质的量之比n:m =_______________ 。
(4)下列有关含氮元素溶液的说法正确的是______________
A.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,
c[(NH4)2Fe(SO4)2] > c[(NH4)2SO4]>c[(NH4)2CO3]
B.常温下,等体积的pH=13的NaOH溶液和pH=1的HNO2溶液混合,所得溶液中
c(Na+)>c(NO2—)>c(OH—)>c(H+)
C.某溶液中只存在OH—、H+、Cl—、NH4+四种离子,其离子浓度c(NH4+)>c(Cl—)>c(OH—)>c(H+),则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—)
D.将NH4Cl溶液蒸干制备NH4Cl固体
E.施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
F.反应NH3(g)+HCl(g)=== NH4Cl(s)在室温下可自发进行,则该反应的△H<0
(5) NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性、原因是
(用离子方程式表示)。向该溶液滴加氨水至溶液b L时呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所得溶液中氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
(6)在恒容密闭容器中,氨基甲酸铵(NH2COONH4)分解反应:
NH2COONH4(s)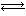 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
① 可以判断该分解反应已经达到平衡的是 。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
② 取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是 (填“增大”,“减小”或“不变”),平衡常数_________(填“增大”,“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
硫是一种很活泼的元素,在适宜的条件下能形成-2、+6、+4、+2、+1价的化合物。
 I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
(1)装置I中的浓硫酸______ (能或不能)用稀硫酸代替,
原因是 。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体,可采取的分离方法是_____________。
(3)装置Ⅲ用于处理尾气,请在虚线内画出尾气处理装置和药品。
(4)检验Na2S2O5晶体在空气中变质的实验方案是 。
II:而另一种硫的化合物Na2S2O3的溶液可以用于测定溶液中ClO2的含量,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是 。
(2)确定滴定终点的现象为__________________________________。
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
(4)下列操作会导致测定结果偏高的是 。
A.未用标准浓度的Na2S2O3溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定应在中性或弱酸性环境中进行,若溶液呈碱性
E.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目: 来源: 题型:
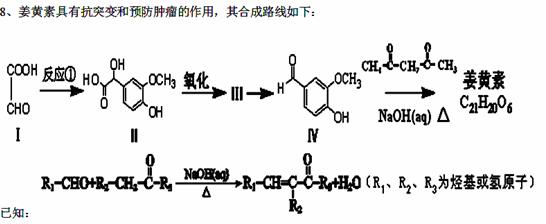 (1)姜黄素的分子中有2个甲基,其结构简式是________________________________。
(1)姜黄素的分子中有2个甲基,其结构简式是________________________________。
(2)反应①中反应物的原子利用率为100%,请写出该反应的化学方程式 。
(3)写出一种符合下列条件的Ⅳ的同分异构体的结构简式 。
①苯环上的一硝基取代物有2种 ②1 mol该物质水解,最多消耗3 molNaOH
多巴胺是一种重要的中枢神经传导物质,用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受,多巴胺可由有机物Ⅳ即香兰素与硝基甲烷反应后再经锌汞齐还原水解制得。合成过程可如上图所示:
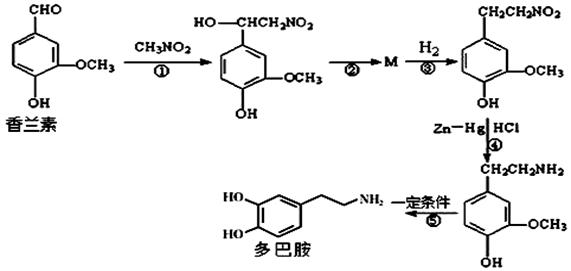
(4)多巴胺的分子式是 。多巴胺的核磁共振氢谱中可以发现有____个特征吸收峰。
(5)反应①的反应类型是 ;反应④的反应类型是 ;
(6)写出反应②发生的化学方程式 。
(7)下列关于多巴胺的说法,正确的是 ___________
A、多巴胺能使FeCl3溶液显紫色 B、多巴胺能与Na2CO3反应,生成CO2
C、多巴胺属于两性有机物 D、多巴胺能发生氧化、还原、取代、加成、消去、中和反应
查看答案和解析>>
科目: 来源: 题型:
现有A、B、C、D、E五种短周期主族元素,其原子序数依次增大,它们之间关系如下:
Ⅰ.原子半径:A < C < B < E<D
Ⅱ.原子的核外电子层数:B = C = 2A
Ⅲ.B元素的主要化合价:最高正价 +最低负价 = 2
Ⅳ.C是周期表中非金属性最强的元素
V.原子的最外层电子数:B + D = 8
VI.E是同周期中半径最小的原子
请回答:
(1)实验室制取E的单质反应离子方程式为_____________________________________。
(2)只有A和B两种元素组成的属于离子晶体的化合物可能为 (用化学式表示)。
(3)由D元素形成的氢氧化物,与强碱溶液反应的离子方程式为 。
下列可作为比较D和Mg金属性强弱的方法是_______(填代号)。
a.测两种元素单质的硬度和熔、沸点 b. 比较最高价氧化物对应的水化物的碱性强弱
c.比较单质与同浓度盐酸反应的剧烈程度 d.. 比较两种元素在化合物中化合价的高低
(4)由B、C元素组成的化合物BC3,该化合物具有强氧化性,与水反应生成两种酸和一种无色气体,该气体常温下遇空气变红棕色,写出该化合物与水反应的化学方程式 ______________________ ______________ ________ 。
(5)由A、B和C三种元素组成的盐,常温下其水溶液显酸性,写出检验该盐中所含阳离子的离子方程式 ;
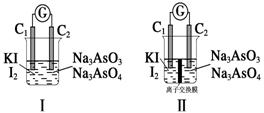 (6)下图Ⅰ、Ⅱ分别是甲、乙两组同学将与B元素同主族的砷元素的化合物按反应“AsO
(6)下图Ⅰ、Ⅱ分别是甲、乙两组同学将与B元素同主族的砷元素的化合物按反应“AsO +2I-+2H+
+2I-+2H+ AsO
AsO +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量40%NaOH溶液,发现电流表指针发生偏转。
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量40%NaOH溶液,发现电流表指针发生偏转。
① 甲组电流表指针都不发生偏转的原因是 。
② 乙组添加的是 (填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目: 来源: 题型:
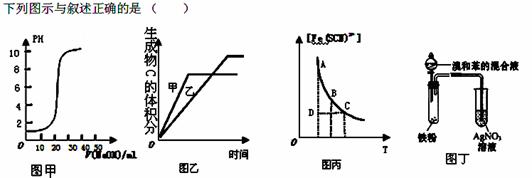
A.图甲表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线
B.图乙表示压强对可逆反应2A (g)+ B (g) 3C (g)+D (s)的影响且甲的比乙的压强大
3C (g)+D (s)的影响且甲的比乙的压强大
C.图丙表示可逆反应Fe3+(aq)+SCN—(aq) Fe(SCN)2+(aq)平衡时,物质的量浓度
Fe(SCN)2+(aq)平衡时,物质的量浓度
[Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆)
D.图丁所示装置可证明溴与苯发生取代反应
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.比例模型 :可以表示二氧化碳分子,也可以表示水分子
:可以表示二氧化碳分子,也可以表示水分子
B.室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+) =1×10-5 mol/L
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素
D.已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol·L-1的AgNO3溶液和
1×10-4 mol·L-1 K2Cr04溶液混合,不会有Ag2CrO4沉淀产生
查看答案和解析>>
科目: 来源: 题型:
下列有关实验的叙述正确的是( )
A.将一定量的氯气通入30 mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
B.实验室可以配制一种仅含Al3+、K+、SO42-、NO3-这4种离子(不考虑来源于水电离的离子)的溶液,且4种离子的浓度均为1mol/L
C.HCl、FeCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到
D.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
查看答案和解析>>
科目: 来源: 题型:
下列有关离子方程式与所述事实相符的是 ( )
A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+==I2+2H2O
B.某溶液中存在大量Fe3+、S2ˉ、Clˉ、Na+,加入NaOH溶液发生反应:Fe3++3OHˉ=Fe(OH)3↓
C.向AlCl3溶液中投入过量的Na: Na+Al3++2H2O=Na++AlO2-+2H2↑
D.将Na2O2固体投入H218O中:2H218O+2Na2O2 = 4OH-+4Na++18O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com