
科目: 来源:专项题 题型:实验题
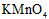 溶液
溶液 

查看答案和解析>>
科目: 来源:期末题 题型:实验题
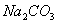 溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。回答下列问题:
溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。回答下列问题:
 溶液的棉花所起的作用是_______________________ ,反应的方程式________________________________________ 。
溶液的棉花所起的作用是_______________________ ,反应的方程式________________________________________ 。 ,铜片是过量的,加热使之反应,当被还原的硫酸为
,铜片是过量的,加热使之反应,当被还原的硫酸为 。则浓硫酸的实际体积_____ (填写“大于”、“等于”或“小于”)
。则浓硫酸的实际体积_____ (填写“大于”、“等于”或“小于”)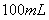 。
。 查看答案和解析>>
科目: 来源:专项题 题型:实验题

查看答案和解析>>
科目: 来源:专项题 题型:实验题
 溶液
溶液 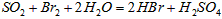

查看答案和解析>>
科目: 来源:同步题 题型:实验题
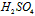 溶液 B.2mol/L NaOH溶液 C.2mol/L
溶液 B.2mol/L NaOH溶液 C.2mol/L  溶液 D.硅酸胶体
溶液 D.硅酸胶体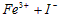 =__________________。请推测HI应具有___________、__________;
=__________________。请推测HI应具有___________、__________;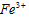 具有____________。
具有____________。 查看答案和解析>>
科目: 来源:0115 同步题 题型:实验题


查看答案和解析>>
科目: 来源:0110 期末题 题型:填空题
查看答案和解析>>
科目: 来源:0110 期末题 题型:实验题
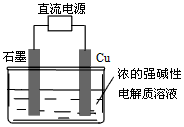
 2H2(g)+O2(g) △H=+484 kJ/mol 不同时段产生O2的量见下表
2H2(g)+O2(g) △H=+484 kJ/mol 不同时段产生O2的量见下表 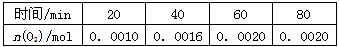

查看答案和解析>>
科目: 来源:0114 期中题 题型:实验题
 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________。
醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________。 的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下
的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下
 。(保留小数点后四位)
。(保留小数点后四位) 
查看答案和解析>>
科目: 来源:同步题 题型:实验题
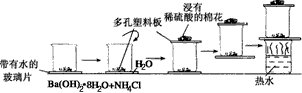

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com