
科目: 来源: 题型:
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO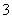 的物质的量为
的物质的量为 mol
mol
③反应过程中转移的电子数为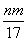 mol
mol
④标准状况下生成NO的体积为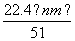 L
L
⑤与合金反应的硝酸的物质的量为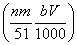 mol
mol
A.5项 B.4项
C.3项 D.2项
查看答案和解析>>
科目: 来源: 题型:
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O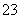 +O2+aOH-===Y+S4O
+O2+aOH-===Y+S4O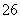 +2H2O,下列说法中,不正确的是( )
+2H2O,下列说法中,不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2O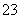 是还原剂
是还原剂
D.每有1 mol O2参加反应,转移的电子为4 mol
查看答案和解析>>
科目: 来源: 题型:
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的化学方程式为MnO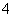 +NO
+NO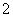 +
+ —→Mn2++NO
—→Mn2++NO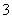 +H2O。下列叙述中正确的是( )
+H2O。下列叙述中正确的是( )
A.该反应中NO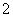 被还原
被还原
B.反应过程中溶液的pH减小
C.生成1 mol NaNO3需消耗0.4 mol KMnO4
D. 中的粒子是OH-
中的粒子是OH-
查看答案和解析>>
科目: 来源: 题型:
LiNi0.25Co0.75O2是锂离子电池的一种高性能的二元正极活性材料,其制备原理可表示为4Ni0.25Co0.75(OH)2+4LiOH+O2===4LiNi0.25Co0.75O2+6H2O(已知Ni与Co的化合价均有+2和+3)。下列说法不正确的是( )
A.Ni0.25Co0.75(OH)2中Ni的化合价是+2
B.LiNi0.25Co0.75O2中Co的化合价是+3
C.该反应中LiOH是还原剂
D.该反应中O2是氧化剂
查看答案和解析>>
科目: 来源: 题型:
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
[已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7]

(金属离子含量与混合液pH、CuCl产率与混合液pH的关系图)
请回答下列问题:
(1)酸浸时发生反应的离子方程式是______________________;析出CuCl晶体时的最佳pH在____左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________________________________________________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70 ℃干燥2小时、冷却,密封包装。70 ℃真空干燥、密封包装的目的是_____________________________________________________________。
(4)产品滤出时所得滤液的主要成分是________________,若想从滤液中获取FeSO4·7H2O晶体,我们还需要知道的是_____________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式________________________________________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及 少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
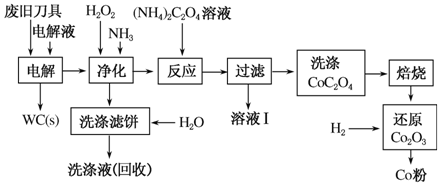
(1)电解时废旧刀具作阳极,不锈钢作阴极,HCl溶液为电解液。阴极主要的电极反应式为________。
(2)净化步骤所得滤饼的主要成分是________。回收的洗涤液代替水配制电解液,目的是回收利用其中的________。
(3)溶液Ⅰ的主要成分是________。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是______________。
(4)将Co2O3还原成Co粉的化学反应方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂等的漂白与杀菌。下图是用过氧化氢法生产亚氯酸钠晶体的工艺流程图:
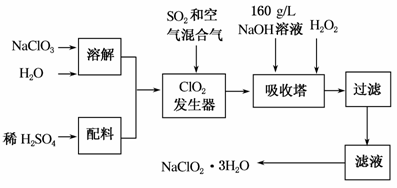
已知:①NaClO2的溶解度随温度升高而增大。
②纯ClO2气体易分解爆炸。
(1)发生器中鼓入空气的作用可能是________(填选项字母,下同)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3氧化成ClO2
(2)吸收塔内发生反应的化学方程式为________________________ _________________。吸收塔内的温度不能超过20 ℃,原因是_____________________________________________________________。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是__________________________。
(4)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是________。
a.Na2O2 b.Na2S c.FeCl2
(5)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________。
a.蒸馏 b.蒸发浓缩 c.灼烧 d.过滤
e.冷却结晶
查看答案和解析>>
科目: 来源: 题型:
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图a所示。
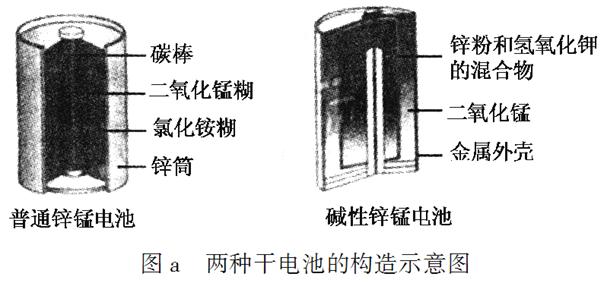
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是__________________________________________________________。
(2)图b表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。

①图b中产物的化学式分别为A________,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为________________________________________。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:

回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为________________、________________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________,滤渣是________;过滤操作②的滤液是________和________,滤渣是________。
(3)工艺过程中③和④的目的是_________________________________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是__________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250 g溶于水,用0.050 0 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为______________________;列式计算该成品的纯度____________________。
查看答案和解析>>
科目: 来源: 题型:
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯,二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
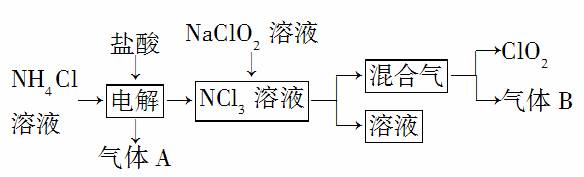
(1)ClO2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________(填 选项字母)。
选项字母)。
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是( )
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室区要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产物难以分离,还可能污染环境。写出该方法发生反应的化学方程式________________________。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是______________________,此法相比欧洲方法的优点是___________________________________________________________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为
_______________________________________________________。
此法提高了生产及储存、运输的安全性,原因是______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com