
科目: 来源: 题型:
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
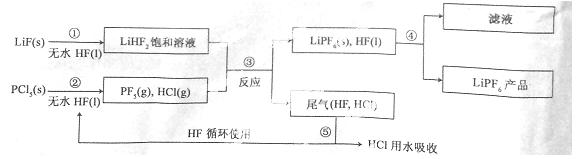
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PCl5极易水解,其产物为两种酸,写出PF5水解的化学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。
(4)LiPF6产品中通常混有少量LiF。取样品wg,测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含有w、n的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质为原料冶炼铝的工艺流程如下:
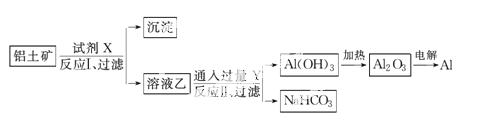
对上述流程中的判断正确的是( )
A.试剂X为稀硫酸,沉淀中含有硅的化合物
B.反应Ⅱ中生成Al(OH)3的反应为CO2+AlO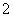 +H2O===Al(OH)3↓+HCO
+H2O===Al(OH)3↓+HCO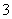
C.结合质子(H+)的能力由强到弱的顺序是OH->AlO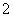 >CO
>CO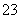
D.Al2O3的熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
查看答案和解析>>
科目: 来源: 题型:
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO, 可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO的离子方程式为_____________________。
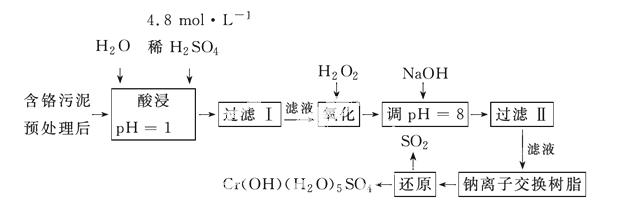
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
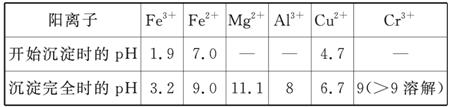
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是__________________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为Mn++nNaR—→MRn+nNa+,被交换的杂质离子是________(填Fe3+、Al3+、Ca2+、Mg2+)。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为
0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①______________;②________________;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)
查看答案和解析>>
科目: 来源: 题型:
氯碱工业是化学工业的基础,如图为一种降低能耗,充分利用氯碱工业产物的联产示意图。

试回答下列问题:
(1)X气体为________(填化学式)。
(2)写出B中燃料电池负极的电极反应式:____________________。
(3)若用浓硫酸处理钛铁矿,并向所得溶液中加入铁,则此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。将上述处理液加水稀释后, 立即析出大量白色沉淀,写出该反应的离子方程式:_______________。

(4)已知:①Mg(s)+Cl2(g)===MgCl2(s) ΔH=-641 kJ·mol-1
②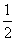 Ti(s)+Cl2(g)===
Ti(s)+Cl2(g)===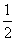 TiCl4(l) ΔH=-385 kJ·mol-1
TiCl4(l) ΔH=-385 kJ·mol-1
写出Mg与TiCl4反应的热化学方程式:_______________,
该反应过程中还应控制的反应条件是________。
查看答案和解析>>
科目: 来源: 题型:
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
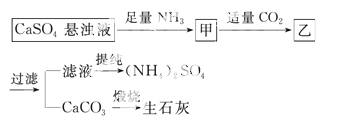
下列推断不合理的是( )
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1 mol (NH4)2SO4至少消耗2 mol NH3
C.CO2可循环使用
D.往甲中通CO2有 利于(NH4)2SO4生成
利于(NH4)2SO4生成
查看答案和解析>>
科目: 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目_________。
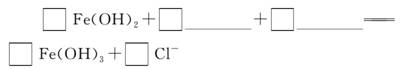
(2)完成“氧化除铁”步骤中反应的离子方程式:
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是____________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________________。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×10-12 | — | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳
c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
科目: 来源: 题型:
C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:
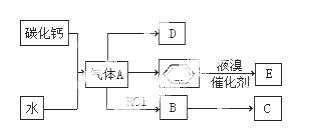
(1)写出A的电子式 ;D的最简式 ;
;D的最简式 ;
(2)写出碳化钙与水
 反应制取A的化学
反应制取A的化学 方程式 ;苯和液溴反应生成E的化学方程式 ,其反应类型为 。B→C的化学方程式 ,其反应类型为 。
方程式 ;苯和液溴反应生成E的化学方程式 ,其反应类型为 。B→C的化学方程式 ,其反应类型为 。
(3)D还可以用石蜡油制取,D在一定条件下存在如下转化关系(石蜡油含17个碳原子以上的液态烷烃,部分反应条件、产物被省略),G是一种酸性物质,H是具有果香气味的烃的衍生物。
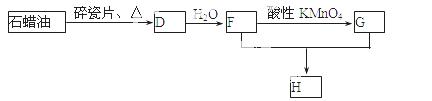
a.工业上,由石油获得汽油、煤油、石蜡油等成份的方法是 ;
b.D→F的化学方程式 
 ,其反应类型是 。
,其反应类型是 。
查看答案和解析>>
科目: 来源: 题型:
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
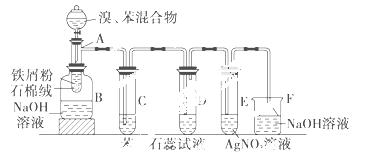
填写下列空白:(注:溴苯与NaOH溶液不可以发生水解反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):(2分)
______________________________________________________ __________________
_________________________________________ _______________________________。
(2)试管C中苯的作用是__ _______;反应开始后,观察D和E试管,看到的现象为:D中:__ ________ _________ ;E中:________ ______。(各2分)
_______;反应开始后,观察D和E试管,看到的现象为:D中:__ ________ _________ ;E中:________ ______。(各2分)
(3)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是(2分)
________________________________________________________________________。
(4)在上述整套装置中,具有防倒吸的仪器有________(填字母)。(2分,错选无分)
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是:(2分 )
)
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ、德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价
凯库勒的观点,某学 生设计了以下实验方案:①按下图所示的装置图连接好各仪器;②检验装置的气密性;
生设计了以下实验方案:①按下图所示的装置图连接好各仪器;②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;④待
烧瓶C中气体收集满后,将导管D的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴
管的胶头,观察实验现象。

试回答:
(1)写出A中发生反应的化学方程式 ;能证明凯库勒观点错误的实验现象是 ;
(2)装置B的作用是 ;
Ⅱ、用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成25
 0mL的待测液。
0mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com