
科目: 来源: 题型:
氯化亚铜在工业上 应用广泛。氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇。
应用广泛。氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇。
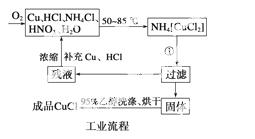
实验药品:铜丝20 g、氯化铵20 g、65%硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为_____________________________________________,
用95%乙醇代替蒸馏水洗涤的主要目的是__________________________________
______________________________________________________________________。
(2)工业化生产时,95%乙醇可通过__________的方法回收并循环利用,而NH4Cl、____________(填化学式)可直接循环利用。
(3)实验室用下图装置制备CuCl。
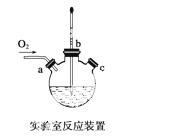
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择下列装置中的________(填字母序号)。
②实验开始时,温度计显示反应液温度低于室温,主要原因是___________________
______________________________________________________________________。
电炉加热升温至50 ℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当______________________________时才能停止通入氧气;待冷却至室温后,再打开瓶塞,沿________(填字母)口倾出棕色反应液于1 000 mL大烧杯,加水500 mL,即有大量白色沉淀析出。
查看答案和解析>>
科目: 来源: 题型:
碱式碳酸铜广泛用于制油漆颜料、烟火、杀虫剂、催化剂、其他铜盐和固体荧光粉激活剂等,也用于种子处理及作 杀菌剂等。某化学兴趣小组在实验室利用Na2CO3·10H2O跟CuSO4·5H2O反应制备并检验碱式碳酸铜,实验步骤如下:
杀菌剂等。某化学兴趣小组在实验室利用Na2CO3·10H2O跟CuSO4·5H2O反应制备并检验碱式碳酸铜,实验步骤如下:


 黏胶状
黏胶状 蓝绿色沉淀
蓝绿色沉淀

 蓝绿色晶体
蓝绿色晶体
(1)写出制备碱式碳酸铜的化学方程式___________________________________。
(2)用研钵分别研细Na2CO3·10H2O和CuSO4·5H2O的目的是___________________。
(3)检验蓝绿色沉淀是否洗涤干净的实验操作是______________________________。
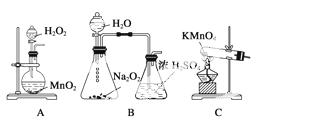
(4)碱式碳酸铜可以看成Cu(OH)2·CuCO3,该兴趣小组同学选择下列实验仪器验证产物中含有Cu(OH)2、CuCO3。
①各装置连接顺序为________________。
②装置B中试剂的名称是__________,装置C中试剂的名称是__________。
③证明含有CuCO3的实验现象是_________________________________________,
证明含有Cu(OH)2的实验现象是_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下性质稳定,加热至560 ℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
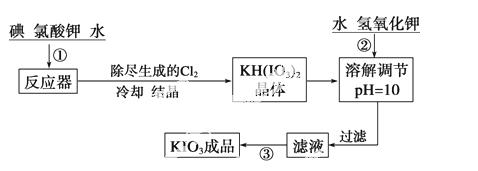
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6∶11,则反应器中发生反应的化学方程式为
_____________________________________________________________________。
(2)步骤②中调节pH=10的目的是_______________________________________。
参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100 g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
操作③的方法是_____________________________________________________。
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有_______________________________________________________________________。
学生乙对纯净的NaCl进行了如下实验:取1 g纯净的NaCl,加3 mL水配成溶液,然后滴入5滴淀粉溶液和1 mL 0.1 mol·L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1 mol·L-1的H2SO4,振荡,一段时间后溶液变浅蓝色。请推测实验中产生蓝色现象的可能原因,用离子方程式表示
______________________________________________________________________。
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇。丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540 ℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:_________________________________________________;
检验沉淀已经洗涤干净的方法是_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为Fe(OH)3:2.7~3.7;Fe(OH)2:7.6~9.6;Zn(OH)2:5.7~8.0,试回答下列问题:
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用________,其理由是
______________________________________________________________________。
(2)加入的试剂②:供选择使用的有:a.Zn粉、b.ZnO、c.Zn(OH)2、d.ZnCO3、e.ZnSO4等,可选用__________。
(3)从晶体1→晶体2,该过程的名称是__________。
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:
| 25 ℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为________。
A.KSCN溶液 B.NaOH溶液
C.KMnO4溶液 D.苯酚溶液
(2)操作Ⅱ中,通入硫化氢至饱和的目的是____________;在溶液中用硫酸酸化至pH=2的目的是_______________________________________________________。
(3)操作Ⅳ的顺序依次为____________、冷却结晶、_________________________。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120 ℃以上发生分解。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图所示)加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
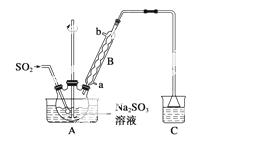
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶,抽滤。
(1)仪器A的名称为__________,冷凝管进水口________(填“a”或“b”),装置C的作用是________________。
(2)①步骤2中,应采用何种加热方式____________,优点是________________;
②冷凝管中回流的主要物质除H2O外还有__________(填化学式)。
(3)在抽滤操作中,仪器除抽气泵、烧杯、玻璃棒、布氏漏斗外,还必须使用属于硅酸盐材料的仪器(或装置)有____________________。抽滤所用的滤纸应略________(填“大于”或“小于”)布氏漏斗内径,并将全部小孔盖住。
(4)步骤3中不在敞口容器中蒸发浓缩的原因是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气,某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下图所示(部分导管、蒸馏水略)。
a.Na2O2 b.浓盐酸 c.碱石灰 d.NaOH溶液 e.淀粉KI溶液 f.CaCO3 g.石蕊试液 h.饱和NaCl溶液
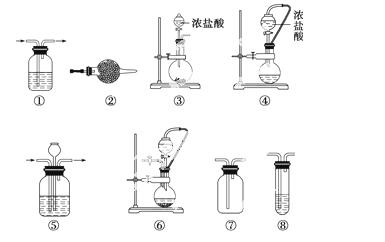
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式_____________________________
______________________________________________________________________。
(2)下表中的装置组合最合理的是__________(填序号,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为__ _____________________________________________________________________。
_____________________________________________________________________。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①_____________________________________________________________________,
②_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO 等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
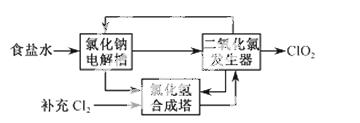
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍
查看答案和解析>>
科目: 来源: 题型:
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
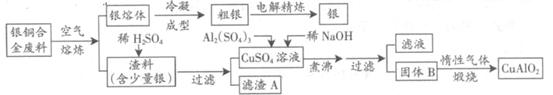
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3 CuAlO2 + ↑。
CuAlO2 + ↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol•L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
查看答案和解析>>
科目: 来源: 题型:
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性 质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
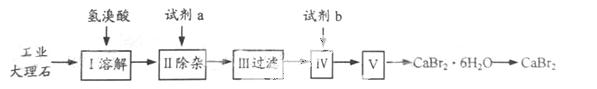
完成下列填空:
35.上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
36.已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 、 。
37.试剂b是 ,步骤Ⅳ的目的是 。
38.步骤Ⅴ所含的操作依次是 、 。
39.制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com