
科目: 来源: 题型:
把Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO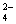 全部转化成BaSO4沉
全部转化成BaSO4沉
淀,此时铝元素的存在形式是
A. Al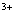 B. Al(OH)3 C. AlO
B. Al(OH)3 C. AlO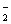 D. Al
D. Al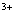 和Al(OH)3
和Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.铁与盐酸反应: Fe + 2H+ ══ Fe3+ + H2 ↑
C.用小苏打治疗胃酸过多: H+ +HCO3-══ H2O + CO2↑
D.Ba(OH)2与稀H2SO4反应: Ba2++OH-+H++SO42-══ BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+ 、MnO4-、Na+、Cl-
B. NH4+、Na+、Cl-、SO42-
C.Na+、H+、NO3-、SO42-
D. K+、Na+、Cl-、CO32-
查看答案和解析>>
科目: 来源: 题型:
下列反应,产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间后 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A.③②①④ B.②③①④ C.③①②④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及氧化变质,在包装袋中应放入的化学物质是
A.无水硫酸铜、蔗糖 B.食盐、硫酸亚铁
C.硅胶、硫酸亚铁 D.生石灰、食盐
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.盐酸既有氧化性,又有还原性
B.金属离子被还原一定得到金属单质
C.阳离子只有氧化性,阴离子只有还原性
D.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质
查看答案和解析>>
科目: 来源: 题型:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液
③ NaF溶液 ④ NaClO溶液。依据数据判断pH由大到小的顺序是 。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.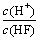 D.
D.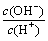
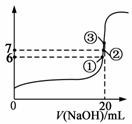 (3)25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
(3)25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
A.pH=3的HF溶液和pH=11的NaF溶液中,
由水电离出的c(H+)相等
B.在①点时pH=6,此时溶液中,
c(F-)-c(Na+) = 9.9×10-7mol/L
C.在②点时,溶液中的c(F-) = c(Na+)
D.在③点时V=20mL,此时溶液中c(F—) < c(Na+)=0.1mol/L
(4)在25℃时,Ksp[Cu(OH)2] =2.0×10-20。 某CuCl2溶液里C(Cu2+)= 0.02 mol·L-1,
如果要生成Cu(OH) 2沉淀,应调整溶液的pH使之大于 。
查看答案和解析>>
科目: 来源: 题型:
化学实验研究中经常用到定量分析。
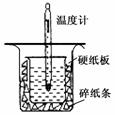 I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
(1)从右图实验装置看,装置中的一个明显错误是
。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值
会_________,(填“偏大”、“偏小”、“ 不变”)
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55 mol·L-1NaOH 溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由 。
Ⅱ.某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
 请回答:
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致
测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:________________,且半分钟内不变色。
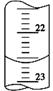
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
查看答案和解析>>
科目: 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子
如右表所示:
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
下图Ⅰ所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27 g。常温下各烧杯中溶液的pH与电解时间t的关系如下图Ⅱ所示。据此回答下列问题:
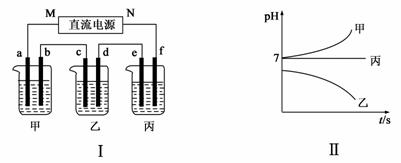
(1)M为电源的________(填“正”或“负”)极,A是________(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积: 。
(3)写出b电极上发生的电极反应 ;
写出乙烧杯的电解池反应:_________________________________ 。
(4)要使丙恢复到原来的状态,应加入 g (填写化学式)。
查看答案和解析>>
科目: 来源: 题型:
I.近年来全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量影响严重,这是目前重要的研究课题 。
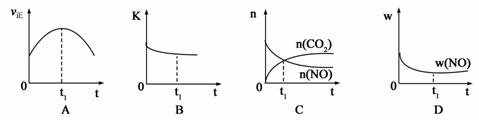
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
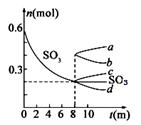 Ⅱ.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关
Ⅱ.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关
键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,右图表
示SO3 物质的量随时间的变化曲线。
① 达到平衡时,用SO2表示的化学反应速率为 。
② 平衡时,SO3的转化率为 (保留小数点后一位);
T1℃时,反应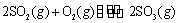 的
的
平衡常数为 ; 其他条件不变,在8min时压缩容器体积至0.5L,
则n(SO3)的变化曲线为 (填字母)。
③右表为不同温度(T)下,反应2SO2(g) + O2(g)  2SO3(g) (△H<0)
2SO3(g) (△H<0)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
的化学平衡常数(K),由此推知,温度最低
的是 (填“T1”、“T2” 或 “T3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com