
科目: 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA
B.0.1 mol·L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含Al 为0.1NA
为0.1NA
C.足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA
D.常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA
查看答案和解析>>
科目: 来源: 题型:
生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是
A.“加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质
B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质
C.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质
D.“酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化
查看答案和解析>>
科目: 来源: 题型:
一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2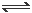 N2O4。反应中测得相关数据如下表所示:
N2O4。反应中测得相关数据如下表所示:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
(1)此条件下该反应的化学平衡常数Kc=________。(填表达式)
 (2)在50 min末,向容器中加入
(2)在50 min末,向容器中加入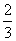 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。
(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率α=________。
查看答案和解析>>
科目: 来源: 题型:
 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是________________________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”) (3) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热的数值________(填“相等”或“不相等”)。
查看答案和解析>>
科目: 来源: 题型:
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S)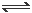 PH3(g) + HI(g) ① ;
PH3(g) + HI(g) ① ;
4PH3(g) 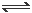 P4(g)+ 6 H2(g) ② ;
P4(g)+ 6 H2(g) ② ;
2HI(g)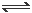 H2(g) + I2(g) ③
H2(g) + I2(g) ③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴ 平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)= ,n(PH3)= 。
⑵ a,b,c三者的关系服从a > (填含b,c的代数式)。
⑶ 平衡后,增大压强,容器内n(I2) , n(PH4I) (增加、减少、不变)
查看答案和解析>>
科目: 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(右图中的△H表示生成1mol产物的数据)。
(1)P和Cl2反应生成PCl3的热化学方程式_____________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________________,
(3)P和Cl2分两步反应生成1molPCl5的
△H3=_________,P和Cl2一步反应生成1molPCl5的△H4__________△H3 (填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是__________________________。
查看答案和解析>>
科目: 来源: 题型:
 在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。
容器中发生如下反应:N2+3H2  2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
 ⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b== 。在此情况下,反应起始时将向 方向(填“正”或“逆”)进行。
⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b== 。在此情况下,反应起始时将向 方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
⑵在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的的转化率_________。
 (4)若升高温度,则平衡时B、C的浓度之比 将______ ___。
(4)若升高温度,则平衡时B、C的浓度之比 将______ ___。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______ _;而维持容器内压强不变,充入氖气时,混合物颜色____ ___(填“变深”“变浅”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
已知两个热化学方程式:C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2 (g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A.1︰1 B.1︰2 C.2︰3 D.3︰2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com