
科目: 来源: 题型:
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1) COCl2的空间构型为 ;溴的价电子排布式为 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
式发生。
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
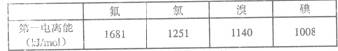
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。
(4)下列分子既不存在s-p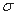 键,也不存在p-p
键,也不存在p-p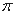 键的是 。
键的是 。
A. HCl B.HF C. SO2 D. SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为 ,写出CN-的等电子体的分子式 (写出1个)。
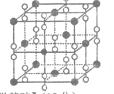
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 。已知该氧化物的密度是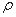 g·cm-3,则晶胞离得最近的两个钙离子间的距离为_ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
g·cm-3,则晶胞离得最近的两个钙离子间的距离为_ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目: 来源: 题型:
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。
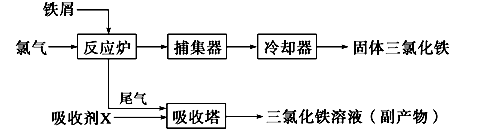
工业上制备无水FeCl3的一种工艺如下:
 (1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为_________________________________________________。
(1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为_________________________________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度 (g/100 g H2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是_______________________。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+ 开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1 ( 已知:Ksp[Fe(OH)3]=1.1×10- 36 ) 。
36 ) 。
(4)吸收剂X是______________________;吸收塔中吸收剂X的作用是_________________________________________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容; 取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol·L-1 Na2S2O3溶液滴定(I2+2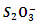
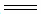 2I-+
2I-+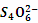 ),共用去V mL。则样品中氯化铁的质量分数为 __________________________。
),共用去V mL。则样品中氯化铁的质量分数为 __________________________。
查看答案和解析>>
科目: 来源: 题型:
开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的。
Ⅰ由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是________。乙是一种清洁燃料,工业上可用甲和氢气反应制得。
(1)T1温度时,在体积为2 L的密闭容器中充入2 mol甲和6 mol H2,反应达到平衡后,测得c(甲)=0.2 mol/L,则乙在平衡混合物中的物质的量分数是 。
(2)升高温度到T2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是________(填字母)。
A.加入2 mol甲 B.充入氮气 C.分离出乙 D.升高温度
Ⅱ(1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知:
CH4(g) + 2O2(g) 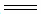 CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g)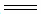 2CO2(g) ΔH2=―566.0 kJ/mol
2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍( 计算结果保留1位小数)。
计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用 甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
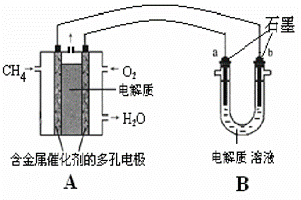
请回答:
①若使用酸性水溶液做电解质,甲烷燃料电池的负极反应式是________。
若使用熔融Na2CO3做电解质,该电池负极的反应式是 。
若使用燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,可以传导O2—。则在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为 。
②若B中为氯化铜溶液,当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
若B中为足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
查看答案和解析>>
科目: 来源: 题型:
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 |
|
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶 液,只
液,只 有A中放出无色气体,只有D中产生白色沉淀;
有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B ___,D 。
(2)C可用作净水剂,用离子方程式表示其净水原理______________。
(3)将含0.01 mol A的溶液与含0.02 mol E的溶液反应后, 向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
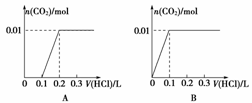
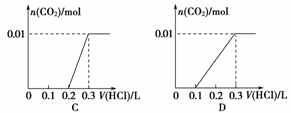
(4)在m mL b mol·L-1 C溶液中,加入等体积a mol·L-1 的E溶液。
当a≤3b时,生成沉淀的物质的量是 mol;
当3b<a<4b时,生成沉淀的物质的量是 mol。
查看答案和解析>>
科目: 来源: 题型:
化学基本概念、化学用语是中学化学学习的重要内容之一。
I:氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:N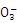 +4H++3e-
+4H++3e-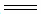 NO+2H2O。
NO+2H2O。
下列四种物质:KMnO4,Na2CO3,Na2SO3,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生。
(1)被还原的元素是___________;还原剂是_________。
(2)写出并配平该氧化还原反应的离子方程式:_________________。
(3)若反应后,还原产物的化合价降低,而其他物质价态保持不变,则反应中氧化剂与还原剂的物质的量之比将_______(填“增大”“不变”减小”或“不能确定”)。
II:实验室需要用Na2CO3 l0H2O配制0.10mol/L Na2CO3溶液240mL。
l0H2O配制0.10mol/L Na2CO3溶液240mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、__________、___________。
(2)计算。
(3)称量。配制该溶液需称取Na2CO3 10H2O晶体_________g。
10H2O晶体_________g。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中Na2CO3 10H2O晶体应放于天平的________(填“左盘”或“右盘”)。
10H2O晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________
(5)转移、洗涤。 (6)定容,摇匀。
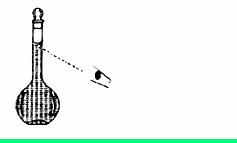
若观察定容时液面情况如图所示,所配溶液的浓度会_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
下列有关电化学知识的叙述正确的是
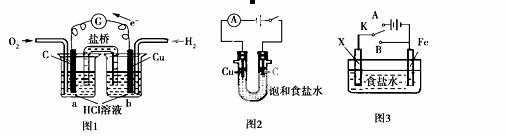
A.图1是原电池装置,铜电极为负极,能实现化学反应:2Cu+O2+4H+ 2Cu2++2H2O
2Cu2++2H2O
B.若去掉图1中的盐桥,该装置的电流表指针也能发生偏转
C.图2是电解池装置,铜电极的反应为:2Cl--2e- Cl2↑
Cl2↑
D.图3中如果X为锌电极,开关K放到A处或放到B处都能使铁电极受到保护
查看答案和解析>>
科目: 来源: 题型:
对于复分解反应:X+Y→Z+W,下列叙述正确的是
A.若Z是强酸,则X和Y必有一种是强酸
B.若X是强酸,Y是盐,反应后可能有强酸或弱酸生成
C.若Y是强碱,X是盐,则Z或W必有一种是弱碱
D.若W是弱碱,Z是盐,则X和Y必有一种是强碱
查看答案和解析>>
科目: 来源: 题型:
下列实验中所选用的仪器或实验基本操作合理的是
①用l0mL量筒量取5.2 mL稀硫酸; ②用酒精洗涤粘有硫粉的试管: ③用托盘天平称量10.1 g氯化钠晶体: ④用过滤的方法除去淀粉胶体中的氯化钠溶液:⑤用饱和NaHCO3溶液除去CO2中的少量SO2
A.①②③④ B.②③④ C.③④⑤ D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
樱桃是一种抗氧化的水果,对人体有很大的益处,樱桃中含有一种羟基酸,具有健脾作用。下列有关说法正确的是
A.该羟基酸含有3种官能团
B.通常条件下,该羟基酸可以发生取代、氧化和加成反应
C.该羟基酸可以在Cu的催化下被O2氧化成醛
D.含1mol该羟基酸的溶液可与含2mol氢氧化钠的溶液恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
下列各组离子能大量共存的是
①“84”消毒液的水溶液中:Fe2+、Cl—、Ca2+、Na+
②加入KSCN显红色的溶液:K+、N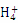 、Cl—、S2—
、Cl—、S2—
③能够与金属Cu常温下反应放出气体的溶液;Fe3+、Al3+、S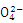 、K+
、K+
④pH=2的溶液中:N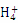 、Na+、Cl—、Cu2+
、Na+、Cl—、Cu2+
⑤无色溶液中:K+、CH3COO—、HC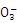 、Mn
、Mn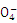
A.②③ B.①③ C.①⑤ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com