
科目: 来源: 题型:
下表中所示物质或概念间的从属关系符合如图的是
|
| X | Y | Z |
| A | 钠元素 | 主族元素 | 短周期元素 |
| B | 电解质 | 化合物 | 纯净物 |
| C | 氢氧化铁 | 胶体 | 分散系 |
| D | 置换反应 | 氧化还原反应 | 放热反应 |

|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:


① 沸腾氯化炉中发生的主要反应为: 。
② 已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则:TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如下图所示,二氧化钛电极连接电源 极,该极电极反应为:
。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种无毒的还原性气体,该气体是 。


(3)海绵钛可用碘提纯,原理为: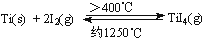 ,下列说法正确的是 。
,下列说法正确的是 。
A.该反应正反应的ΔH>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2 可循环利用
查看答案和解析>>
科目: 来源: 题型:
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
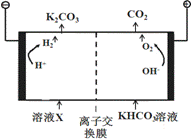
在阳极区发生的反应包括 和H ++ HCO3- == H2O + CO2↑。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) + 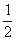 O2(g) === H2O(g) Δ H1= —242 kJ·mol-1
O2(g) === H2O(g) Δ H1= —242 kJ·mol-1
CH3OH(g) + O2(g) === CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
O2(g) === CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
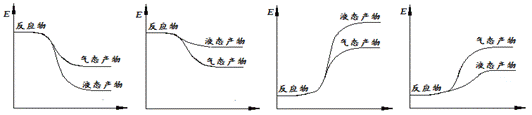
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:

①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
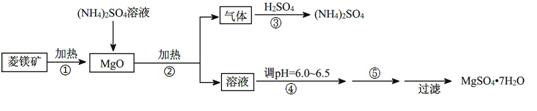 (1)步骤②中发生反应的离子方程式为 。
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目: 来源: 题型:
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为
V2O5+xLi LixV2O5。下列说法中正确的是
LixV2O5。下列说法中正确的是
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时为阳极
C.该电池充电时阳极的反应为LixV2O5﹣xe-═V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目: 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5)是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为试样的pH=______。
(2)NOx 汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则反应N2(g)+O2(g) 2NO(g)
2NO(g) 
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应:__________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_______。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)2+M NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
查看答案和解析>>
科目: 来源: 题型:
下列有关金属腐蚀与防护的说法正确的是
A.在酸性环境下,钢铁只能发生析氢腐蚀
B.金属腐蚀的实质是金属失去电子被还原的过程
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法
D.铜铁交接处,在潮湿的空气中直接发生反应:Fe-3e-===Fe3+,继而形成铁锈
查看答案和解析>>
科目: 来源: 题型:
可逆反应:A(g) 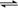 B(g),其反应过程中能量变化如下图所示,下列说法错误的是
B(g),其反应过程中能量变化如下图所示,下列说法错误的是
(以Ea表示活化能,Ea(正)、Ea(逆)分别表示正、逆反应活化能)
A.该反应的 ΔH = Ea(正) - Ea(逆)
B.该反应的Ea(正) = E3 - E2
C.只要温度升高,该可逆反应就会向逆反应方向进行
D.可逆反应B(g) 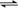 A(g)的ΔH = E2 - E1
A(g)的ΔH = E2 - E1
查看答案和解析>>
科目: 来源: 题型:
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 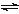 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
科目: 来源: 题型:
(Ⅰ)如图所示:
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀。
请写出正极反应式 。
(2)若开始时开关K与b连接时,两极均有气体产生,
则N端是电源的 极(填正或负)则总反应的离子方程式为 。
 |
(Ⅱ)用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。

(1)X极与电源的_____(填“正”或“负”)极相连,氢气从_____(填“A、B、C或D”)口导出。
(2)已知离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”)交换膜。
(3)若制得标准状况下5.6 L氧气,则生成氢氧化钾的质量是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com