
科目: 来源: 题型:
下列说法正确的是( )
A.糖类化合物都具有相同的官能团
B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇
D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目: 来源: 题型:
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
A.15种 B.28种
C.32种 D.40种
查看答案和解析>>
科目: 来源: 题型:
下列关于有机化合物的说法正确的是( )
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.戊烷(C5H12)有两种同分异构体
C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键
D.糖类、油脂和蛋白质均可发生水解反应
查看答案和解析>>
科目: 来源: 题型:
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )

A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液中羧基和羟基均能电离出H+
查看答案和解析>>
科目: 来源: 题型:
下列鉴别方法不可行的是( )
A.用水鉴别乙醇、甲苯和溴苯
B.用燃烧法鉴别乙醇、苯和四氯化碳
C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55~60 ℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
查看答案和解析>>
科目: 来源: 题型:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
| 物 质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
 ②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要
装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0
mL无水乙醇、一定量的苯、沸石……;装上油水
分离器和冷凝管,缓慢加热回流至反应完全。
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,
搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏。
⑴ 第一步操作中,还缺少的试剂是 ;加入苯的目的是 ;实验过程中,酯化反应进行完全的标志是 。
⑵ 第二步中证明“水洗”已经完成的实验方案是 。
⑶ 第三步可以得到较纯净的乳酸乙酯,为获得更纯净的乳酸乙酯,可采用 法。
⑷ 利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有 个峰。
查看答案和解析>>
科目: 来源: 题型:
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是
;Y、Z的这些氢化物的沸点相差较大的主要原因是
 ⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合
物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有
σ键的数目是 。
⑸Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的
化学式是 ,Z原子的配位数是 。
查看答案和解析>>
科目: 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
⑴ 将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
⑵ NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: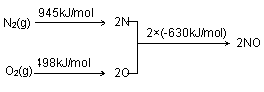
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
② 当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。你的依据是 。
⑶ 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
 铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
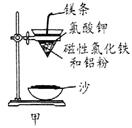

⑴ 某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
⑵ 若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
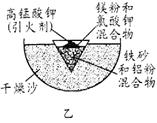
⑶ 为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。
 |
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com