
科目: 来源: 题型:
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程脱硫实现了________(填选项字母)。
A.废弃物的综合利用 B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是
__________________________________________________________。
(3)已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s)
ΔH=-520 kJ/mol
S(s)+O2(g)===SO2(g) ΔH=-297 kJ/mol
Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1 065 kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是____________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是_________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是_____________________________________。
(6)假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。
查看答案和解析>>
科目: 来源: 题型:
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
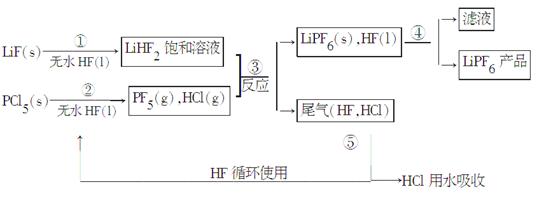
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是_______、________。反应设备不能用玻璃材质的原因是________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:
__________________________________________________________。
(3)第④步分离采用的方法是__________________;第⑤步分离尾气中HF、HCl采用的方法是__________________________________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、 n的代数式表示)。
n的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
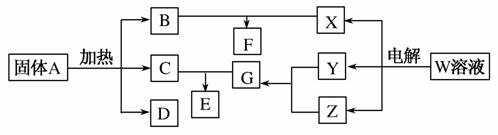
A、B、C、D、E、F、X存在如图所示转化关系,其中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。X可能是强酸,也可能是强碱。











(1)A的化学式是______________________________________。
(2)若X是强酸,将D与Cl2同时通入水中发生反应的离子方程式为________________________________。
(3)若X是强碱,过量的B跟Cl2反应除生成C外,另一产物是氯化物。
①过量的B跟Cl2反应的化学方程式为________________________。
②工业生产中B→D的化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
下图所示的无机物的转化关系中,部分生成物和反应条件已略去。其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子。

(1)写出X的电子式________;E中含有的化学键类型是________。
(2)Z与C以物质的量之比为31反应也能生成G,同时生成另一种二元化合物H,已知该反应中只有一种元素的化合价发生改变,则H的化学式为________。H大量用于面粉的漂白和消毒,它与水反应的化学方程式为___________________________________________________。
(3)将体积均为560 mL(标准状况)的B和Z同时缓缓通入水中,得到1.0 L溶液,则溶液中c(H+)=________mol/L。
(4)A~G七种物质中,属于电解质的有________种。
查看答案和解析>>
科目: 来源: 题型:
如图是中学化学常见物质之间的转化关系,其中A、C、D、F、I为单质,其余为化合物,C和D在点燃或者加热的条件下生成淡黄色的固体,B常温下为液态。

试回答下列有关问题:
(1)图中①~⑥反应中属于非氧化还原反应的是________(填反应序号);写出其反应的化学方程式________________________。
(2)化合物K、J、G中含有的相同的元素在周期表中的位置是________;D单质的一种同素异形体有很强的氧化性,可用于杀菌消毒,写出它的化学式________。
(3)写出反应②的化学方程式____________________;当有1 mol A反应时,转移电子的物质的量为________ mol。
(4)写出反应④的一种重要的工业用途________。
(5)用A与F作电极材料,插入K 溶液中,形成闭合回路,写出负极电极反应式________________。
溶液中,形成闭合回路,写出负极电极反应式________________。
查看答案和解析>>
科目: 来源: 题型:
已知在一个1 L的密闭容器中放入4 mol N2O5气体后会发生如下两种反应:①N2O5(g)N2O3(g)+O2(g);②N2O3(g)N2O(g)+O2(g)。在某温度下达到平衡后c(O2)=4.4 mol·L-1,c(N2O3)=1.6 mol·L-1。求反应中N2O5的分解率。
查看答案和解析>>
科目: 来源: 题型:
在真空密闭容器中加入a mol固体PH4I,在一定的温度下发生如下反应:
PH4I(s)PH3(g)+HI(g)①
4PH3(g)P4(g)+6H2(g)②
2HI(g)H2(g)+I2(g)③
以上三个反应建立平衡后,测得HI为b mol,I2为c mol,H2为d mol,求:
(1)平衡后容器内P4和PH3的物质的量:________(用代数式表示)。
(2)a、b、c三者遵循的关系:a>________(填b、c的关系式)。
查看答案和解析>>
科目: 来源: 题型:
在一恒容密闭容器中充入1 mol NO2,建立如下平衡2NO2(g)N2O4(g),测得NO2的转化率为a%,在其他条件不变的情况下再充入1 mol NO2,待新平衡建立时,NO2的转化率为b%,则a与b的关系为( )
A.a>b B.a<b C.a=b D.无法确定
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中充入4 mol X,在一定温度下发生反应4X(g)3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是( )
A.3.4 mol B.4 mol
C.2.8 mol D.1.2 mol
查看答案和解析>>
科目: 来源: 题型:
一定温度下,反应2SO2(g)+O2(g)2SO3(g),达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com