
科目: 来源: 题型:
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

 ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是____________。
ΔH=+88.6 kJ·mol-1,则M、N相比,较稳定的是____________。
(2)已知CH3OH(l)的燃烧热 为238.6 kJ·mol-1,CH3OH(l)+
为238.6 kJ·mol-1,CH3OH(l)+ O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a______238.6(填“>”、“<”或“=”)。
O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a______238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:______________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为____________。
查看答案和解析>>
科目: 来源: 题型:
把煤作为燃料可通过以下两种途径,途径Ⅰ:C(s)+O 2(g)===CO2(g);ΔH1<0。途径Ⅱ:先制水煤气:C(s)+H2O(g)===CO(g)+H2(g);ΔH2>0,再燃烧水煤气:2CO(g)+O2(g)===2CO2(g);ΔH3<0,2H2
2(g)===CO2(g);ΔH1<0。途径Ⅱ:先制水煤气:C(s)+H2O(g)===CO(g)+H2(g);ΔH2>0,再燃烧水煤气:2CO(g)+O2(g)===2CO2(g);ΔH3<0,2H2 (g)+O2(g)===2H2O(g);ΔH4<0。
(g)+O2(g)===2H2O(g);ΔH4<0。
请回答下列问题:
(1)比较两种途径的放热情况:途径Ⅰ放出的热量__ __(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3和ΔH4的数学关系式是____________。
(3)由于制取水煤气的反应中,反应物具有的总能量____
生成物具有的总能量,那么在进行化学反应时,反应物就需要________能量才能转化为生成物, 因此其反应条件是________。
查看答案和解析>>
科目: 来源: 题型:
氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1 ①
4Al(s)+2O3(g)===2Al2O3(s) ΔH2 ②
3O2(g)===2O3(g) ΔH3 ③
则 ( )
A.ΔH1-ΔH2=ΔH3 B.ΔH1+ΔH2=ΔH3
C.ΔH2-ΔH1=ΔH3 D.ΔH1+ΔH2+ΔH3=0
查看答案和解析>>
科目: 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol--1,则氢气的燃烧热为241.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) △H=a、2C(s)+O2(g)=2CO(g) △H=b,则a>b
D.已知P (白磷,s)=P (红磷,s) △H<0,则白磷比红磷稳定
查看答案和解析>>
科目: 来源: 题型:
下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g) ===2H2O(g) ΔH=—483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1
B.若C(石墨,s) ===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=—57.4 kJ·mol-1, 则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g) ===2CO2(g) ΔH1;2C(s)+O2(g) =2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目: 来源: 题型:
天然气的主要成 分是甲烷,它既是一种优质的燃料,又是制氢的化工原料。制氢反应可通过以下两个反
分是甲烷,它既是一种优质的燃料,又是制氢的化工原料。制氢反应可通过以下两个反
应实现:①CH4(g)+ O2(g)===CO(g)+2H2(g);ΔH=-36 kJ/mol,②CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH
O2(g)===CO(g)+2H2(g);ΔH=-36 kJ/mol,②CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH
=+216 kJ/mol。下列说法正确的是
A.由上述两个热化学方程式不能得出氢气与氧气反应生成气态水的热化学方程式
B.反应①不能自发进行
C.甲烷既是一种化石能源,又是一种可再生能源
D.由上述两个反应可以计算出氢气的燃烧热
查看答案和解析>>
科目: 来源: 题型:
已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3
C.1∶4 D.2∶3
查看答案和解析>>
科目: 来源: 题型:
碘在不同状态下(固态或气态)与氢气反应的热化学方程
式如下所示:
①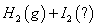 =
=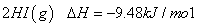
②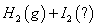 =
=
下列判断正确的是
A.①中的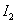 为固态,②中的
为固态,②中的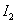 为气态
为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比反应②的产物热稳定性更好
D.1mol固态碘升华时将吸热17kJ
查看答案和解析>>
科目: 来源: 题型:
某反应的反应过程中能量变化如右图所示(图中E表示
 活化能)。下列叙述正确的是( )
活化能)。下列叙述正确的是( )
A.逆反应的活化能大于正反应的活化能
B.该反应为放热反应
C.催化剂能改变反应的焓变
D.催化剂能降低反应的活化能
查看答案和解析>>
科目: 来源: 题型:
在273 K、101 kPa、催化剂存在的条件下,发生了某化学反应,书写该反应的热化学方程式时,一般不需注明的是
A.反应物或生成物的状态
B.反应时的温度
C.反应时的压强
D.反应时所用的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com