
科目: 来源: 题型:
下列有关金属的工业制法中正确的是 ( )
A.制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛
B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
查看答案和解析>>
科目: 来源: 题型:
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗
框、卷帘门、防护栏等。下列与这些用途无关的性质是 ( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
查看答案和解析>>
科目: 来源: 题型:
钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点
高、密度小、可塑性好、易于加工、耐腐蚀等,尤其是钛合金与人体器官具有很好的“生物相容性”。据它们的主要性能,下列用途不切合实际的是 ( )
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于家庭装修,做钛合金装饰门
查看答案和解析>>
科目: 来源: 题型:
工业 上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

 (1)气体A中的大气污染物可选用下列试剂中的 吸收.
(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B ,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象).
,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 .
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研
人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
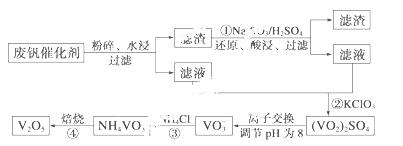
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
(2)图中所示滤液中含钒的主要成分为 (写化学式)。
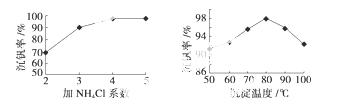
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。
(4)用硫酸酸化的H2C2O4溶液滴定(V O2)2SO4溶液,以测定反应②后溶液中含钒量,
O2)2SO4溶液,以测定反应②后溶液中含钒量, 完成反应的离子方程式为□VO2++□H2C2O4+□_____ =□VO2++□CO2↑+□H2O。
完成反应的离子方程式为□VO2++□H2C2O4+□_____ =□VO2++□CO2↑+□H2O。
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ 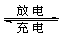 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程
如下:
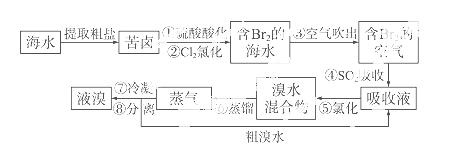
(1)溴在周期表中位于第 _周期第 _族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 _。
(3)步骤④利用了SO2的还原性,反应的离子方程式为 _。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因 _ 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 _。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是 _。
查看答案和解析>>
科目: 来源: 题型:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
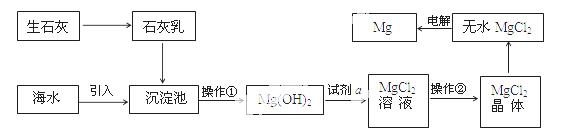
提示:  ①MgCl2晶体的化学式为MgCl2•6H2O;
①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 , 操作②的名称 、 、过滤。
(2)试剂a的名称是 。
(3)用氯化镁电解生产金属镁的化学方程式为: 。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的 方法制金属镁,其原因是 。
方法制金属镁,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法错误的是( )
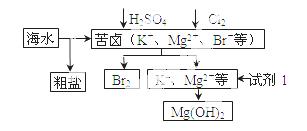
A.试剂1可以选用石灰乳
B.从苦卤中提取Br2的反应的离子方程式为:2Br - + Cl2=2Cl- + Br2
C.工业上,电解熔融MgO冶炼金属镁可减小能耗
D.可用BaCl2溶液除去粗盐中的SO42-
查看答案和解析>>
科目: 来源: 题型:
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少 量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O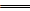 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn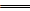 2Au+
2Au+ Na2[Zn(CN)4]。
Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是( )
A.Na[Au(CN)2]不溶于水
B.化合物Na[Au(CN) 2]中金元素的化合价为+1
C.金元素在地壳中能以化合态的形式存在
D.在提炼过程中含金元素的物质始终作氧化剂
查看答案和解析>>
科目: 来源: 题型:
在冶金工业上,均不能用通常化学还原剂制得的金属组是( )
A.Na,Mg,Al B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag D.Mg,Al,Zn,Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com