
科目: 来源: 题型:
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是 ( )
A.氢键;分子间作用力;极性键
B.氢键;氢键;非极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
查看答案和解析>>
科目: 来源: 题型:
下图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 ( )
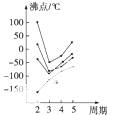
A.H2S B.HCl C.PH3 D.SiH4
查看答案和解析>>
科目: 来源: 题型:
下列关于σ键和π键的理解不正确的是 ( )
A.σ键能单独形成,而π键一定不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.双键中一定有一个σ键,一个π键,三键中一定有一个σ键,两个π键
D.气体单质中一定存在σ键,可能存在π键
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是 ( )
A.分子的键长越长,键能越高,分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为H—O—H,分子的键角为180°
D.H—O键键能为462.8 kJ·mol-1,即18克H2O分解成H2和O2时,消耗能量为2×462.8 kJ
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,错误的是 ( )
A.只含非极性键的纯净物一定是单质
B.只含极性键的纯净物一定是化合物
C.只含离子键的纯净物一定存在金属元素
D.纯净物中一定存在化学键
查看答案和解析>>
科目: 来源: 题型:
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子中每个原子接2个单键和一个双键,它与F2发生加成反应,其加成产物的分子式为 ;C60的晶体结构类似于干冰,则每个C60晶胞的质量为 (用含NA的式子表示)。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是 。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有( )
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力;
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)立方BN结构与金刚石相似,晶胞结构如下图,在BN晶体中,B原子周围最近的N原子所构成的立体图形为 ,B原子与N原子之间共价键与配位键的数目比为 ,一个晶胞中N原子数目为 。
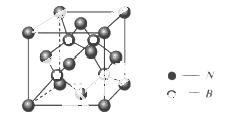
(5)碳与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为 ,金属铜采用面心立方最密堆积,则Cu的晶体中Cu原子的配位数为 。已知Cu单质的晶体密度为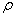 g•cm-3,Cu的相对原子质量为M,阿伏伽德罗常数NA,则Cu的原子半径为 。
g•cm-3,Cu的相对原子质量为M,阿伏伽德罗常数NA,则Cu的原子半径为 。
查看答案和解析>>
科目: 来源: 题型:
(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
A. NH4Cl晶体 B. Na3AlF6晶体 C. Na2CO3•10H2O晶体
D. CuSO4溶液 E. CH3COOH溶液
(4)部分共价键键能数据如下表:
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式: 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F六种短周期元素,
其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的
原子最外层电子数是次外层电子数的三倍,D是所在周期中原子半径最大的主族元素。又知六种元素所形
成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题。
(1)元素D在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________________。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________。
(4) ①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
②若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________________________________________________________。
③FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com