
科目: 来源: 题型:
在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2+SO2 NO+SO3,下列叙述正确的是 ( )
NO+SO3,下列叙述正确的是 ( )
A.在任何时刻NO和SO3的物质的量一定相等
B.在平衡状态时NO2和SO2的物质的量一定相等
C.在任何时刻体系中的总物质的量一定等于反应开始时总物质的量
D.在平衡状态时SO2、NO2、NO、SO3的物质的量一定相等
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是 ( )
A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键
B.含有共价键的物质一定是共价化合物
C.分子中一定含有化学键
D.含有金属元素的离子一定是阳离子
查看答案和解析>>
科目: 来源: 题型:
下列关于有机物的说法错误的是 ( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.等物质的量的乙醇和乙烯完全燃烧时所需氧气的质量相等
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使KMnO4溶液褪色,说明苯不能发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
下列说法中错误的是 ( )
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
查看答案和解析>>
科目: 来源: 题型:
关于元素周期律和周期表的下列说法正确的是( )
A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着原子序数的增加而呈周期性变化
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化
查看答案和解析>>
科目: 来源: 题型:
I、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
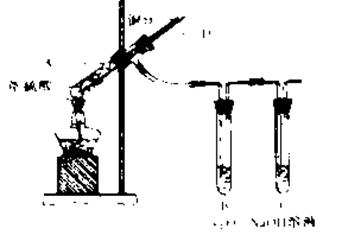
实验步骤:
①先连接好装置,检查气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为____________________.
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是_________________.
(3)若将B中品红溶液换成溴水,通入一段时间后溴水褪色,这说明了二氧化硫具有漂白性,你是否同意这个观点___________,(填“同意”或“不同意”),说明理由_________(用离子方程式表示)。
II、以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体。其过程如下图所示。
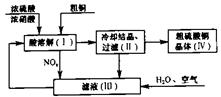
回答下列问题:
(4)配平在滤液(III)中发生反应的化学方程式:
_____NOx+____H2O+___O2=____HNO3
(5)写出制取硫酸铜的总反应方程式:_______________________.
(6)在上述生产过程中,被循环使用的物质是________________.
查看答案和解析>>
科目: 来源: 题型:
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:
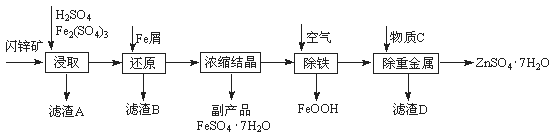 (1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为 。
(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
查看答案和解析>>
科目: 来源: 题型:
某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如下图所示:
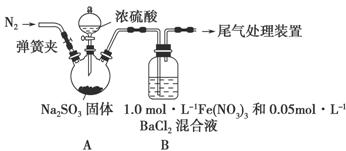
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答下列问题:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是
。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生白色沉淀的原因:
猜想1: ;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3—反应;
①按猜想2,装置B中反应的离子方程式是 。
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 (填字母)。
a.0.1 mol·L-1硝酸钠溶液 b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
查看答案和解析>>
科目: 来源: 题型:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:
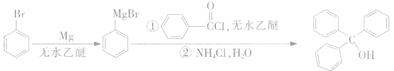
实验步骤如下:
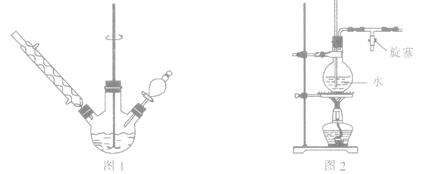
①如图1所示,在三颈烧瓶中加入1.5 g镁屑,在滴液漏斗中加入6.7 mL溴苯和无水乙醚,先加人1/3混合液于烧瓶中,待镁屑表面有气泡产生时,开始搅拌,并逐滴加入余下的混合液,使反应液保持微沸状态,至反应完全。
②继续加入3.7 g苯甲酰氯和无水乙醚,水浴回流l h 后,在冷水浴下慢慢滴加氯化铵的饱和溶液30.0 mL。
③将三颈烧瓶内的物质水浴加热蒸去乙醚,然后加入30.0 mL水进行水蒸气蒸馏(图2用作水蒸气发生装置),直至无油状物蒸出。
④冷却抽滤,将固体用80.0%的乙醇溶液重结晶,最终得到产品。
(1)步骤①中“逐滴加入余下的混合液”是为了防止 。
(2)若水蒸气蒸馏装置中出现堵塞现象,则图2玻璃管中水位会突然升高,此时应 ,待故障排除后再进行蒸馏。
(3)抽滤用到的主要仪器有气泵、 ,抽滤优于普通过滤的显著特点是 。
(4)步骤④中用80.0%的乙醇溶液重结晶的目的是 。
(5)用光谱法可检验所得产物是否纯净,其中用来获得分子中含有何种化学键和官能团信息的方法 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com