
科目: 来源: 题型:
1-对甲苯基-3-苯基-2-丙烯-1-酮(以下用M表示)是一种常见的工业原料,其结构简式为: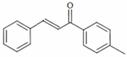 ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):
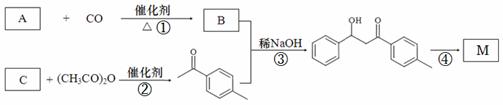
已知:在稀碱作用下,两分子的醛或酮可以互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
请回答下列问题:
(1)有机物B的名称为 。
(2)物质A、C的关系为 。
a.同系物 b.同分异构体 c.同素异形体 d.分子式相差1个CH2
(3)①~④反应中,属于加成反应的有 。
(4)反应②的化学方程式为 。
(5)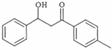 的同分异构体有许多。能与NaHCO3反应,且含有联苯基(
的同分异构体有许多。能与NaHCO3反应,且含有联苯基(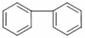 上1个氢原子被取代)的同分异构体共有 种。
上1个氢原子被取代)的同分异构体共有 种。
查看答案和解析>>
科目: 来源: 题型:
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的电负性从大到小排列顺序为 。
③醋酸分子中的两个碳原子,甲基(—CH3)碳和羧基(—COOH)碳的杂化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。
a.离子键 b. 配位键 c. σ键 d. π键
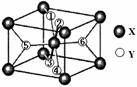 (2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是 。
a.XY2晶体>硅烷晶体>固态氨 b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体 d.硅烷晶体>固态氨>XY2晶体
查看答案和解析>>
科目: 来源: 题型:
煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是 。煤的液化技术又分为直接液化和间接氧化。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为 。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放。
①在燃烧前,可以采用微生物脱硫技术。原理如下:

上述过程中Fe2+的作用为 。写出Fe2+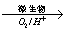 Fe3+的离子方程式 。
Fe3+的离子方程式 。
②煤在燃烧时,进行脱硫处理,常采用 燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为 (填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入 设备,用石灰水淋洗。
查看答案和解析>>
科目: 来源: 题型:
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置。
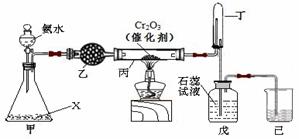
(1)若分液漏斗中氨水的浓度为9.0mol·L-1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进装置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 ;为测定试管丁内硝酸溶液的浓度,从中取10mL溶液于锥形瓶中,用0.1 mol·L-1的NaOH溶液滴定。滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是 。
查看答案和解析>>
科目: 来源: 题型:
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-。为除去杂质离子,部分操作流程如下:
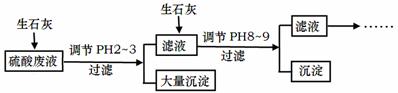
请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的浓度为4.9g·L-1,则该溶液中的pH约为 。
(2)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4] c(NH4Cl)(填:<、=或>)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中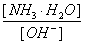 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要操作步骤:向沉淀中加入过量 ,充分反应后,过滤、洗涤、 。
(5)25℃, H3AsO4电离常数为K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是 。
②Na3AsO4第一步水解的平衡常数数值为: 。
③已知:AsO43-+2I-+2H+= AsO33-+I2+H2O ,SO2+I2+2H2O=SO42-+2I-+4H+ 。上述两个反应中还原性最强的微粒是 。
查看答案和解析>>
科目: 来源: 题型:
工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2 则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2 则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0 min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0 min ~ 2min 内H2的平均反应速率为 。
②达平衡时, CH4的转化率为 。在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比 (填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______。(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。
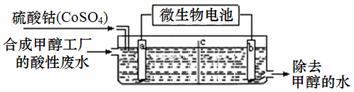
①a电极的名称为 。
②写出除去甲醇的离子方程式 。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
ToC时,在一固定容积的密闭容器中发生反应:A(g)+B(g) C(s) ∆H < 0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s) ∆H < 0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
 A.ToC时,该反应的平衡常数值为4
A.ToC时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于ToC
D.ToC时,直线cd上的点均为平衡状态
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
B.根据CO2通入漂白粉水溶液中,溶液先变浑浊后澄清,推断SO2通入也有同样现象
C.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的
AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI)
D.将Fe(NO3)2晶体溶于稀硫酸,滴加KSCN溶液,通过观察溶液变红确定硝酸亚铁晶体已被氧化
查看答案和解析>>
科目: 来源: 题型:
某溶液可能含有Na+、Fe3+、Br﹣、I﹣、HCO3﹣、SO32﹣、NO3﹣等离子①向该溶液中滴加氯水,无气泡产生,溶液呈橙色;②向橙色溶液中加入BaCl2溶液产生白色沉淀;③向橙色溶液中滴加淀粉溶液未变蓝,则在该溶液中肯定存在的离子组是
A.Na+、I﹣、SO32﹣ B.Na+、Br﹣、SO32﹣
C.Fe3+、Br﹣、NO3﹣ D.Na+、Br﹣、NO3﹣
查看答案和解析>>
科目: 来源: 题型:
将10.7gMg、Al和Fe组成的合金溶于足量的氢氧化钠溶液中,产生标准状况下3.36L气体。另取等质量的合金溶于过量盐酸中,生成标准状况下7.84L气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀物质的量为
A. 0.1mol B. 0.2mol C.0.25mol D. 0.3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com