
科目: 来源: 题型:
常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示忽略温度变化)。下列说法中错误的是 )。
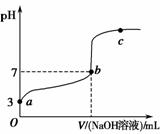
A.a与b之间的溶液中只存在:cCH3COO-)>cNa+)>cH+)>cOH-)
B.b与c之间的溶液中不存在:cCH3COO-)>cH+)>cNa+)>cOH-)
C.b点时,VNaOH溶液)<20 mL,且cCH3COO-)=cNa+)
D.a、b、c点表示的溶液中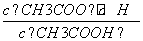 均相等
均相等
查看答案和解析>>
科目: 来源: 题型:
下列溶液中各微粒的浓度关系正确的是 )。
A.等pH的氨水、KOH溶液、BaOH)2溶液中:cNH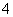 )=cK+)=cBa2+)
)=cK+)=cBa2+)
B.将10 mL 0.1 mol·L-1Na2CO3溶液逐滴滴入10 mL 0.1 mol·L-1盐酸中:cNa+)>cCl-)>cHCO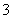 )>cCO
)>cCO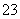 )
)
C.向NH4HCO3溶液中滴加NaOH溶液至pH=7:cNH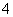 )+cNa+)=cHCO
)+cNa+)=cHCO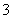 )+cCO
)+cCO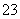 )
)
D.0.2 mol·L-1某一元弱酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后的溶液:2cOH-)+cA-)=2cH+)+cHA)
查看答案和解析>>
科目: 来源: 题型:
下列有关电解质溶液中微粒的物质的量浓度关系正确的是双选) )。
A.在0.1 mol·L-1 NaHCO3溶液中:cNa+)>cHCO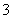 )>cCO
)>cCO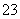 )>cH2CO3)
)>cH2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:cOH-)-cH+)=cHCO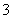 )+2cH2CO3)
)+2cH2CO3)
C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:cCO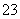 )>cHCO
)>cHCO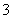 )>cOH-)>cH+)
)>cOH-)>cH+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,cNa+)=0.1mol·L-1]:cNa+)
=cCH3COO-)>cCH3COOH)>cH+)=cOH-)
查看答案和解析>>
科目: 来源: 题型:
室温时,下列溶液中微粒的浓度关系正确的是 )。
A.0.1 mol·L-1 pH=4的NaHSO3溶液中:cHSO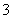 )>cSO
)>cSO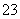 )>cH2SO3)
)>cH2SO3)
B.等体积、等物质的量浓度的NaF溶液与HF溶液混合:cNa+)=cF-)+cHF)
C.在NaHA溶液中一定有:cNa+)+cH+)=cHA-)+cOH-)+cA2-)
D.cNH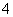 )相等的NH4)2CO3、NH4)2SO4和NH4)2FeSO4)2三份溶液中,溶质的物质的量浓度依次增大
)相等的NH4)2CO3、NH4)2SO4和NH4)2FeSO4)2三份溶液中,溶质的物质的量浓度依次增大
查看答案和解析>>
科目: 来源: 题型:
cNH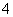 )相同的下列溶液①NH4Cl ②NH4)2SO4 ③NH4HSO4 ④NH4HCO3。其物质的量浓度由大到小的顺序是 )。
)相同的下列溶液①NH4Cl ②NH4)2SO4 ③NH4HSO4 ④NH4HCO3。其物质的量浓度由大到小的顺序是 )。
A.②③①④ B.④①③②
C.①④③② D.②④①③
查看答案和解析>>
科目: 来源: 题型:
某课外活动小组测定了某工厂工业废水中游离态氯的含量,下面是测定实验分析报告请填写有关空白):
一)测定目的:测定工厂工业废水中的游离态氯的含量
二)测定原理:Cl2+2KI===2KCl+I2;I2+2Na2S2O3===2NaI+Na2S4O6
三)实验用品及试剂:
1)仪器和用品自选,略)
2)试剂:指示剂________填名称),KI溶液,浓度为0.010 mol/L 的标准Na2S2O3溶液,蒸馏水等。
四)实验过程:
1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液足量),滴入指示剂2~3滴。
2)取碱式滴定管经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mL/L Na2S2O3溶液待用。
3)将锥形瓶置于滴定管下方进行滴定,眼睛注视______直至滴定终点,滴定至终点的现象是__________________________。
五)数据记录与处理:请在下面表格中的有括号的横线上填上必要的物理量,不必填数据)
| 滴定 次数 | ______) | ____________) | |||
| ______) | ______) | ______) | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 |
若经数据处理,滴定中消耗标准的Na2S2O3溶液的体积平均是20.00 mL,则废水中Cl2的物质的量浓度为________,从实验过程分析,此浓度比实际浓度________填“偏大”、“偏小”或“相等”),造成误差的原因是
________________________________________________________若认为没有误差,该问可不答)。
六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是________填编号)。
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
查看答案和解析>>
科目: 来源: 题型:
一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1 mol·L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是________填字母序号)。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用60 mL的稀硫酸标准溶液,配制时应选用100 mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定结束时俯视读数,则导致实验结果偏大
查看答案和解析>>
科目: 来源: 题型:
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是 )。
A.酸式滴定管在装液前未用标准酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.滴定前平视读数,滴定后俯视读数
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目: 来源: 题型:
用FeCl3酸性溶液脱除H2S后的溶液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol·L-1。
②Ⅳ中检测Cl2的实验方法_________________。
③与Ⅱ对比,得出的结论(写出两点): _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com