
科目: 来源: 题型:
氮元素可以形成多种化合物.回答以下问题:
(1)N≡N的键能为942kJ•mol﹣1,N﹣N单键的键能为247kJ•mol﹣1.计算说明N2中的 键更稳定(填“π”或“σ”).
(2)N2与O22+互为等电子体,O22+的电子式可表示为 .
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被﹣NH2(氨基)取代形成的另一种氮的氢化物.
①NH3分子的空间构型是 ;N2H4分子结构式为 .
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=﹣1038.7kJ•mol﹣1
若该反应中有4mol N﹣H键断裂,则形成的π键有 mol.
查看答案和解析>>
科目: 来源: 题型:
短周期主族元素M、X、Y、R、W的原子序数逐渐增大,X原子的p轨道半充满,且X、Y同周期,Y与R的价电子数相同.R原子核外有16个运动状态不同的电子。
(1)X元素的基态原子的电子排布图为__________________,R元素的基态原子有____个未成对电子。
(2)Y与Na的离子半径由小到大的顺序为 ;(用元素符号表示)
(3)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式).该元素在周期表中的位置为________________________________
(4)短周期元素M与Al元素位于不同主族,但由于二者的电负性相近,导致某些性相似,将M的最高价氧化物溶于氢氧化钠溶液中,发生反应的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
按下列要求写出由第二周期非金属元素组成的中性分子的相关内容:
(1)平面三角形分子:分子式 .
(2)三角锥形分子:分子式 ,VSEPR模型(价层电子对互斥模型)为 .
(3)正四面体形分子:结构式 .
(4)互为等电子体的两对物质的分子式:N2和 ,CO2和 .
查看答案和解析>>
科目: 来源: 题型:
有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( )
A.A3BC4 B.A2BC4 C.A2BC3 D.ABC4
查看答案和解析>>
科目: 来源: 题型:
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z形成的分子空间构型可能是正四面体
D.WY2分子中δ键与π键的数目之比是2:1
查看答案和解析>>
科目: 来源: 题型:
关于键长、键能和键角,下列说法不正确的是 ( )
A.键角的大小与键长、键能的大小无关
B.键长的大小与成键原子的半径和成键数目有关
C.键角是描述分子立体结构的重要参数
D.键能越大,键长越长,共价化合物越稳定
查看答案和解析>>
科目: 来源: 题型:
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如图,则下列判断错误的是( )
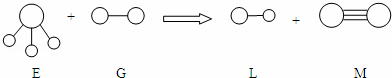
A.G是最活泼的非金属单质 B.L的稳定性小于E
C.E能使紫色石蕊试液变蓝色 D.M化学性质比较稳定
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.π键是由两个p电子以“头碰头”方式重叠而成
B.1molC2H2中有4molσ键
C.乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D.H2分子中含σ键,Cl2分子中含π键
查看答案和解析>>
科目: 来源: 题型:
以下有关元素性质的说法不正确的是( )
A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2
④1s22s22p63s23p4 原子半径最大的是①
B.具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最
大的是③
C.①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③
D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,
当它与氯气反应时可能生成的阳离子是X3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com