
科目: 来源: 题型:
二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料,物质间的转化关系如图所示。下列说法正确的是(双选)( )。
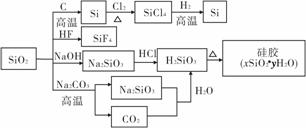
A.SiO2既能与HF反应, 又能与NaOH反应,属于两性氧化物
B.SiO2是光导纤维材料,Si是半导体材料
C.在硅胶中加入CoCl2可显示硅胶是否吸水失效
D.图中所示转化反应都是非氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可制备出超高强度的高性能混凝土。下列关于二氧化硅的说法正确的是
( )。
A.二氧化硅溶于水生成硅酸,所以二氧化硅属于酸性氧化物
B.将二氧化碳通入硅酸钠溶液中可以得到硅酸
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.水晶是比较纯净的二氧化硅,沙子的主要成分是硅酸盐
查看答案和解析>>
科目: 来源: 题型:
下列有关硅及其化合物的说法正确的是( )。
A.单质硅常用作半导体和光导纤维材料
B.硅在自然界中只以化合态的形式存在
C.SiO2与纯碱高温生成CO2,说明硅酸的酸性比碳酸强
D.SiO2是非金属氧化物,它不与任何酸反应
查看答案和解析>>
科目: 来源: 题型:
为了探究新制饱和氯水的组成和性质而进行了如下科学实验:先观察了氯水的外观性质以后,再用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。请回答下列问题:
(1)写出新制饱和氯水中含有氯元素物质的化学式:
__________________________________________。
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据:____________________。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明:
①__________________________________________。
②__________________________________________。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
[实验步骤]
①取试管内的无色溶液3 mL盛于另一支洁净的试管中;
②________________,振荡试管。
[实验现象及结论]
①若________________,则证明溶液红色褪去的原因是①而不是②;
②若________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目: 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是(双选)( )。
A.氯气的性质很活泼,与氢气混合后立即发生爆炸
B.实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
C.新制氯水的氧化性强于久置氯水
D.除去Cl2气体中的HCl,可将气体通入饱和食盐水
查看答案和解析>>
科目: 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3 (aq)+S(s)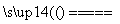 Na2S2O3 (aq)
Na2S2O3 (aq)
实验步骤:
① 称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。 另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分夹持装置略去),水浴加热, 微沸60分钟。
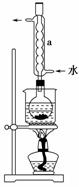
③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________________________
__________________________________________。
(2)仪器a的名称是________,其作用是__________________________________________
__________________________________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无
机杂质是________。 检验是否存在该杂质的方法是__________________________________________
__________________________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: __________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂, 用0.100 0 mol·L-1碘的标准溶液滴定。 反应原理为:2S2O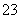 +I2===S4O
+I2===S4O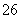 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______________ mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。 Ⅲ.Na2S2O3的应用

(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO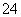 ,常用作脱氯剂,该反应的离子方程式为__________________________________________
,常用作脱氯剂,该反应的离子方程式为__________________________________________
__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
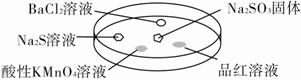
下表中对实验现象的描述或所做的解释不正确的是( )。
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目: 来源: 题型:
下列关于硫及其化合物的说法中正确的是( )。
A.自然界中不存在游离态的硫
B.二氧化硫的排放会导致光化学烟雾的产生
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可用来干燥SO2、CO、Cl2等气体
查看答案和解析>>
科目: 来源: 题型:
向200 mL稀硝酸溶液中加入11.2 g铁粉,充分反应后,铁粉全部溶解并放出NO气体,溶液质量增加7.0 g,则所得溶液中Fe3+的物质的量浓度约为
( )。
A.0.1 mol/L B.0.2 mol/L
C.0.3 mo/L D.0.4 mo/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com